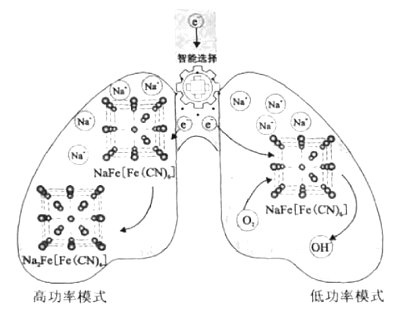
题目内容
【题目】乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得知,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O该组同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;请回答:
(1)将草酸晶体配制成溶液时,必须用到的玻璃仪器是烧杯、玻璃棒、_____、______。
(2)滴定时,将KMnO4标准液装在右图中的________(填“甲”或“乙”)滴定管中。
![]()
(3)本实验滴定达到终点的标志是________。
(4)通过上述数据,计算出x=________。
(5)下列滴定操作会使测得的x值偏大的是________。
A.滴定终点时俯视滴定管刻度
B. 滴定终点时仰视滴定管刻度
C.滴定时所用的KMnO4溶液因久置而导致浓度变小
D.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
【答案】100mL容量瓶 胶头滴管 甲 当最后一滴高锰酸钾滴入,溶液突然出现紫色(或紫红色),且半分钟内不褪色 2 A
【解析】
(1)配制100.00 mL一定物质的量浓度的草酸溶液,所需用到的玻璃仪器有烧杯、玻璃棒、100mL容量瓶、 胶头滴管,故答案为:100mL容量瓶、胶头滴管;
(2)因为KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装,故答案为:甲;
(3)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫色,故答案为:当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
(4)设25mL草酸溶液中含草酸的物质的量为x mol,由题目所给化学方程式可知:
2MnO4-+ 6H+ + 5H2C2O4= 2Mn2++10CO2↑+8H2O
2 5
0.1000 mol/L×10.00 mL×10-3 L/mL x mol
x=(0.100 0 mol/L×10.00 mL×10-3 L/mL×5)/2=2.5×10-3 mol,
由此可计算出1.260g纯草酸晶体中含H2C2O4的物质的量为:
n(H2C2O4)=2.5×10-3 mol×(100 mL/25 mL)=0.0100 mol,
则1.260 g H2C2O4xH2O中含H2O的物质的量为:(1.260 g-0.0100 mol×90 g/mol)/18 g/mol=0.020 0 mol,计算可得:x=2。
(5)
A. 滴定终点时俯视滴定管刻度,则所读消耗酸性KMnO4溶液的体积偏小,由此计算所得n(H2C2O4)偏小,则n(H2O)偏大,x偏大;
B. 滴定终点时仰视滴定管刻度,则所读消耗酸性KMnO4溶液的体积偏大,由此计算所得n(H2C2O4)偏大,则n(H2O)偏小,x偏小;
C.滴定时所用的KMnO4溶液因久置而导致浓度变小,则消耗KMnO4溶液的体积偏大,由此计算所得n(H2C2O4)偏大,则n(H2O)偏小,x偏小;
D.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失,则所读酸性KMnO4溶液的体积偏大,由此计算所得n(H2C2O4)偏大,则n(H2O)偏小,x偏小;
答案应选A。

【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是__。基态K+的电子排布式为__。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是__,中心原子的杂化方式为__。NaBH4中存在__(填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为__,其中Be的配位数为__。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:___。
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=__g·cm-3(列出计算表达式)。