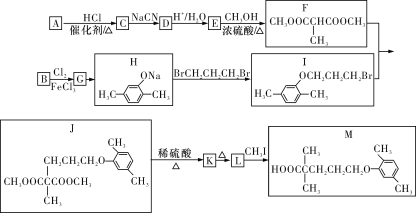
题目内容
【题目】经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质。查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题。
(1)试推测能组成这种溶液的可能的溶质组合有__________种(填数字)。
(2)有关这种溶液,下列说法不正确的是______
A.若溶液中离子间满足c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl 和NH3·H2O
B.若溶液中离子间满足c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质一定只有NH4Cl
C.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
D.若溶液中c(NH3·H2O)>c(Cl-),则溶液一定显碱性
(3)若溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)__c(NH3·H2O)(填“>”、“<”或“=”),简述理由_____________。
(4)水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的HCl滴定V L同浓度NH3·H2O时得到的滴定曲线。试分析如图所示滴定过程中的a、b、c、d各点,水的电离程度最大的是____________理由为______________________________。

(5)写出a点、c点所对应溶液中各离子浓度由大到小的比较顺序
a点:______________________________________________________________
c点:______________________________________________________________
【答案】3B<pH为7的溶液,一定是氨水与氯化铵的混合溶液,即混合时氨水略过量,c(HCl)<c(NH3·H2O)c分析题图可知,c点时盐酸和氨水正好完全反应,生成氯化铵溶液,这时水的电离程度最大c(NH4+)>c(Cl-)>c(OH-)>c(H+)c(Cl-)>c(NH4+)>c(H+)>c(OH-)
【解析】
(1)由溶液中存在的阴阳离子电荷守恒判断可能的溶质微粒;
(2)A、分析离子浓度关系可知溶液呈碱性判断溶液中的溶质;
B、溶液呈酸性的溶质可以是NH4Cl,NH4Cl和HCl;
C、结合溶液中电荷守恒分析;
D、结合溶液中电荷守恒分析;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则c(H+)=c(OH-),溶液中的溶质是氯化铵和氨水;要使混合溶液呈中性,则氨水的物质的量大于HCl;
(4)NH3·H2O对水的电离起抵制作用,而NH4Cl对水的电离起促进作用;
(5)用一定浓度的HCl滴定V L同浓度NH3·H2O,a是氨水和氯化铵的混合物,c是氯化铵溶液;
(1)某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知该溶液中含有一种或两种溶质,查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,依据溶液中存在的阴阳离子结合电荷守恒分析判断可能的溶质微粒为,NH4Cl、NH3·H2O和NH4Cl、NH4Cl和HCl,组成这种溶液的可能的溶质组合有3种;
(2)A.等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,若溶液中离子间满足c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl和NH3·H2O,故A正确;
B.若溶液中离子间满足c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质可以是NH4Cl或NH4Cl和HCl混合溶液,故B错误;
C.若溶液中c(NH4+)=c(Cl-),溶液中电荷守恒,c(Cl-)+c(OH-)=c(NH4+)+c(H+),c(OH-)=c(H+),则该溶液一定显中性,故C正确;
D.等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,若溶液中c(NH3·H2O)>c(Cl-),则溶液中溶质为NH3·H2O和NH4Cl,一定显碱性,故D正确;
故选B.
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则c(H+)=c(OH-),溶液中的溶质是氯化铵和氨水;要使混合溶液呈中性,则氨水的物质的量大于HCl,混合前c(HCl)<c(NH3·H2O),pH为7的溶液,一定是氨水与氯化铵的混合溶液,即混合时氨水略过量,c(HCl)<c(NH3·H2O);
(4)NH3·H2O对水的电离起抵制作用,而NH4Cl对水的电离起促进作用,所以两者恰好完全反应生成氯化铵,对水电离促进程度最大,即为c,分析题图可知,c点时盐酸和氨水正好完全反应,生成氯化铵溶液,这时水的电离程度最大;
(5)a点是等浓度的氨水和氯化铵的混合物,一水合氨电离大于铵根离子电离溶液显碱性,溶液中离子浓度:c(NH4+)>c(Cl-)>c(OH-)>c(H+),c点是恰好完全反应生成的氯化铵溶液,铵根离子水解溶液显酸性,离子浓度为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案