题目内容
5.写出下列反应的化学方程式,并注明氧化剂、还原剂①“曾青得铁化为铜”:CuSO4+Fe=FeSO4+Cu,氧化剂:CuSO4;还原剂:Fe;
②用CO还原Fe2O3炼铁:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,氧化剂:Fe2O3;还原剂:CO.
分析 ①“曾青得铁化为铜”:湿法炼铜为铁和硫酸铜发生置换反应生成硫酸亚铁和铜,铁元素的化合价升高,铜元素的化合价降低;
②用CO还原Fe2O3炼铁:工业冶铁为三氧化二铁和一氧化碳反应,反应生成铁和二氧化碳,碳元素的化合价升高,铁元素的化合价降低.
解答 解:①“曾青得铁化为铜”:湿法炼铜CuSO4+Fe=FeSO4+Cu,反应中铜元素化合价从+2价变化为0价,化合价降低得到电子,所以CuSO4做氧化剂,铁元素的化合价从0价变化为+2价,元素化合价升高失电子,所以铁做还原剂,
故答案为:CuSO4+Fe=FeSO4+Cu,氧化剂:CuSO4;还原剂:Fe;
②用CO还原Fe2O3炼铁:工业冶铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,反应中铁元素化合价从+3价变化为0价,化合价降低得到电子,所以Fe2O3做氧化剂,碳元素的化合价从+2价变化为+4价,元素化合价升高失电子,所以CO做还原剂,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,氧化剂:Fe2O3;还原剂:CO.
点评 本题考查化学反应及氧化还原反应中氧化剂、还原剂的判断,元素化合价的变化是氧化还原反应的判断依据和特征,依据化合价变化分析,“升失氧,降得还”,题目难度不大.

练习册系列答案
相关题目
4.基态原子的核外电子排布为[Kr]4d105s1的元素属于的区、周期和族为( )
| A. | p区、第五周期、ⅠB族 | B. | ds区、第五周期、ⅠB族 | ||
| C. | d区、第四周期、ⅠB族 | D. | ds区、第五周期、Ⅷ族 |
5.下列化学用语表达不正确的是( )
| A. | 氨分子的电子式: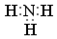 | B. | CO2分子的结构式:O=C=O | ||
| C. | S2-的离子结构示意图: | D. | 苯分子的结构简式: |
2.下列各对物质含有不同官能团的是( )
| A. | CH3CH2 CH2CH3和 CH3CH(CH3)2 | |
| B. | CH3CH2 CH2COOH 和 HOOCCH2CH2CH2CH3 | |
| C. | CH3CH2OH 和CH3OCH3 | |
| D. | CH2=C(CH3)2和CH3CH=CHCH3 |
9.设NA为阿伏加德罗常数的数值,下列说汰正确的是( )
| A. | 5.8g由正丁烷与异丁烷组成的混合气体中含有的C-H键数目为NA | |
| B. | 将0.2mol NH3充入容器中加热分解,生成N2的分子数为0.1NA | |
| C. | 1L 0.1mol•L-1 NaHCO3溶液中HCO3-和CO32-数目之和为0.1NA | |
| D. | 当过量的铜与浓HNO3反应生成22.4L气体时,转移的电子数为NA |
10.已知阿伏伽德罗常数可表示为NA,则下列说法正确的是( )
| A. | 17gNH3所含中子数目为10 NA | |
| B. | 常温常压下,22 g氧气和26 g臭氧所含的氧原子总数为3NA | |
| C. | 常温常压下,18g H2O含有的电子总数为8NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
17.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温下,500mL 2mol•L-1的Na2CO3溶液中含Na+数目为NA | |
| B. | 常温下,2.7g铝与足量盐酸反应,失去电子数为0.3NA | |
| C. | 1.8gNH4+的离子中含有的质子数为0.1NA | |
| D. | 标准状况下,1 L水所含分子数为$\frac{1}{22.4}$NA |
14.以下物质间的转化通过一步反应不能实现的是( )
| A. | Na---Na2O2---Na2CO3---NaHCO3 | B. | Fe---Fe3O4---FeCl2---Fe(OH)3 | ||
| C. | Si---SiO2---H2SiO3---Na2SiO3 | D. | S---SO2---SO3--H2SO4 |
15.下列关于铁及其化合物的说法不正确的是( )
| A. | 炼铁原料有铁矿石、焦炭、空气和石灰石 | |
| B. | FeCl3溶液能使KI淀粉溶液变蓝色 | |
| C. | 灼热的铁丝放入盛有干燥氯气的集气瓶中燃烧生成棕色的烟雾 | |
| D. | 利用Cu与FeCl3溶液的反应制作印刷电路板 |