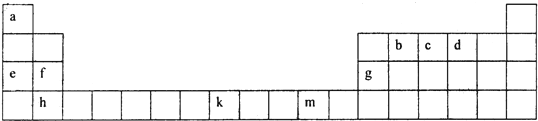
题目内容
用杂化轨道理论及VSEPR理论判断:| 物质 | 轨道杂化行使 | 分子或离子的性状 | |||
| (1) | BCl3 | ||||
| (2) | PO
|
||||
| (3) | NCl3 | ||||
分析:根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数.
解答:解:(1)BCl3中价层电子对个数=σ键个数+孤电子对个数=3+
=3,所以原子杂化方式是sp2,分子形状为平面三角形,
故答案为:sp2;平面三角形;
(2)PO
中价层电子对个数=σ键个数+孤电子对个数=4+
=4,所以原子杂化方式是sp3,分子形状为正四面体,
故答案为:sp3;正四面体;
(3)NCl3中价层电子对个数=σ键个数+孤电子对个数=3+
=4,所以原子杂化方式是sp3,分子形状为三角锥形,
故答案为:sp3;三角锥形.
| 3-3×1 |
| 2 |
故答案为:sp2;平面三角形;
(2)PO
3- 4 |
| 5+3-4×2 |
| 2 |
故答案为:sp3;正四面体;
(3)NCl3中价层电子对个数=σ键个数+孤电子对个数=3+
| 5-3×1 |
| 2 |
故答案为:sp3;三角锥形.
点评:本题考查了原子杂化方式的判断和微粒的空间构型的判断,根据价层电子对互斥理论来分析解答即可,注意孤电子对个数的计算方法,为易错点.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目


 不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.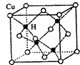 所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为
所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为