题目内容
[化学-选修/物质结构与性质]
(1)①对硝基苯酚水合物(2C6H5NO3?3H2O)晶体属于分子晶体,实验表明,加热至94℃时该晶体失去结晶水,该晶体失去结晶水的过程,破坏的微粒间的主要作用力属于 .
②一种铜与金形成的合金,其晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子的数目之比为 .
(2)下表为元素周期表的一部分,根据此表回答下列问题:
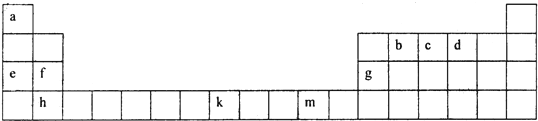
①f、g、h三种元素的第一电离能由小到大的顺序是 (用元素符号表示),b、c、d三种元素的电负性由大到小的顺序是 (用元素符号表示),b、c、d分别与a形成的简单化合物分子中,属于含有极性键的非极性分子是 .(填写化学式)
②有一种元素x和上表中所列元素k位于同周期、同一族且不相邻的位置,请写出元素x原子的基态价电子排布式 .
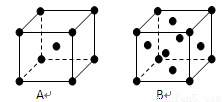
目前,利用金属或合金作为储氢材料的研究取得很大进展,如图是一种La-x合金储氢后的晶胞结构图.该合金储氢后,含有lmol La(镧)的合金中吸附的H2的数目为 .
③科学家把由c、d、e组成的离子化合物ecd 3和e2d在一定条件下反应得到一种白色晶体,该晶体中的阴离子为cd
,其中各原子的最外层电子均满足8电子稳定结构.该阴离子的中心原子的杂化轨道方式为 杂化,阴离子的电子式为 .
(1)①对硝基苯酚水合物(2C6H5NO3?3H2O)晶体属于分子晶体,实验表明,加热至94℃时该晶体失去结晶水,该晶体失去结晶水的过程,破坏的微粒间的主要作用力属于
②一种铜与金形成的合金,其晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子的数目之比为
(2)下表为元素周期表的一部分,根据此表回答下列问题:

①f、g、h三种元素的第一电离能由小到大的顺序是
②有一种元素x和上表中所列元素k位于同周期、同一族且不相邻的位置,请写出元素x原子的基态价电子排布式

目前,利用金属或合金作为储氢材料的研究取得很大进展,如图是一种La-x合金储氢后的晶胞结构图.该合金储氢后,含有lmol La(镧)的合金中吸附的H2的数目为
③科学家把由c、d、e组成的离子化合物ecd 3和e2d在一定条件下反应得到一种白色晶体,该晶体中的阴离子为cd
3- 4 |
分析:(1)①对硝基苯酚水合物(2C6H5NO3?3H2O)晶体属于分子晶体,结晶水通过氢键与硝基苯酚结合;
②根据均摊法计算晶胞中Cu、Au原子数目,据此解答;
(2)由元素在周期表中的位置可知,a为H、b为C、c为N、d为O、e为Na、f为Mg、g为Al、h为Ca、K为Fe、m为Cu,
①Mg原子2s能级为全满稳定状态,第一电离能高于同周期相邻元素,一般金属性越强第一电离能越小;同周期自左而右电负性增大;C、N、O分别与H形成的简单化合物分子中,甲烷为正四面体、氨气为三角锥型、水为V型,甲烷分子中正负电荷重心重合,是含有极性键的非极性分子;
②x与元素Fe位于同周期、同一族且不相邻的位置,则x为Ni;根据均摊法计算晶胞中Ni原子、氢气分子数目,据此解答;
③阴离子为NO43-,计算N原子价层电子对数确定N原子杂化方式,结合各原子的最外层电子均满足8电子稳定结构可知N原子与氧原子之间形成1对共用电子对,O氧原子有3对孤对电子.
②根据均摊法计算晶胞中Cu、Au原子数目,据此解答;
(2)由元素在周期表中的位置可知,a为H、b为C、c为N、d为O、e为Na、f为Mg、g为Al、h为Ca、K为Fe、m为Cu,
①Mg原子2s能级为全满稳定状态,第一电离能高于同周期相邻元素,一般金属性越强第一电离能越小;同周期自左而右电负性增大;C、N、O分别与H形成的简单化合物分子中,甲烷为正四面体、氨气为三角锥型、水为V型,甲烷分子中正负电荷重心重合,是含有极性键的非极性分子;
②x与元素Fe位于同周期、同一族且不相邻的位置,则x为Ni;根据均摊法计算晶胞中Ni原子、氢气分子数目,据此解答;
③阴离子为NO43-,计算N原子价层电子对数确定N原子杂化方式,结合各原子的最外层电子均满足8电子稳定结构可知N原子与氧原子之间形成1对共用电子对,O氧原子有3对孤对电子.
解答:解:(1)①对硝基苯酚水合物(2C6H5NO3?3H2O)晶体属于分子晶体,结晶水通过氢键与硝基苯酚结合,加热至94℃时该晶体失去结晶水,破坏的微粒间的主要作用力属于氢键,故答案为:氢键;
②晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目为6×
=3、Au原子数目为8×
=1,故合金中Cu原子与Au原子的数目之比为3:1,故答案为:3:1;
(2)由元素在周期表中的位置可知,a为H、b为C、c为N、d为O、e为Na、f为Mg、g为Al、h为Ca、K为Fe、m为Cu,
①Mg原子2s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素,一般金属性越强第一电离能越小,故第一电离能Ca<Al<Mg;同周期自左而右电负性增大,故电负性O>N>C;C、N、O分别与H形成的简单化合物分子中,甲烷为正四面体、氨气为三角锥型、水为V型,氨气、水为极性分子,甲烷分子中正负电荷重心重合,故含有极性键的非极性分子是CH4,故答案为:Ca<Al<Mg;O>N>C;CH4;
②x与元素Fe位于同周期、同一族且不相邻的位置,则x为Ni,其基态价电子排布式为3d84s2;晶胞中Ni原子数目为8×
=1、氢气分子数目为12×
=3,故含有lmol La(镧)的合金中吸附的H2的数目为3NA,
故答案为:3d84s2;3NA;
③阴离子为NO43-,N原子价层电子对数=4+
=4,故N原子杂化方式为sp3,NO43-中各原子的最外层电子均满足8电子稳定结构,可知N原子与氧原子之间形成1对共用电子对,O氧原子有3对孤对电子,其电子式为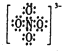 ,故答案为:sp3;
,故答案为:sp3;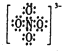 .
.
②晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目为6×
| 1 |
| 2 |
| 1 |
| 8 |
(2)由元素在周期表中的位置可知,a为H、b为C、c为N、d为O、e为Na、f为Mg、g为Al、h为Ca、K为Fe、m为Cu,
①Mg原子2s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素,一般金属性越强第一电离能越小,故第一电离能Ca<Al<Mg;同周期自左而右电负性增大,故电负性O>N>C;C、N、O分别与H形成的简单化合物分子中,甲烷为正四面体、氨气为三角锥型、水为V型,氨气、水为极性分子,甲烷分子中正负电荷重心重合,故含有极性键的非极性分子是CH4,故答案为:Ca<Al<Mg;O>N>C;CH4;
②x与元素Fe位于同周期、同一族且不相邻的位置,则x为Ni,其基态价电子排布式为3d84s2;晶胞中Ni原子数目为8×
| 1 |
| 8 |
| 1 |
| 4 |
故答案为:3d84s2;3NA;
③阴离子为NO43-,N原子价层电子对数=4+
| 5+3-2×4 |
| 2 |
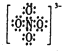 ,故答案为:sp3;
,故答案为:sp3;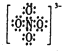 .
.点评:本题是物质结构与性质的综合题目,涉及化学键、分子结构与性质、电离能、电负性、核外电子排布规律、晶胞计算等,难度中等,需要学生全面掌握基础知识,注意利用均摊法进行晶胞的有关计算.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目