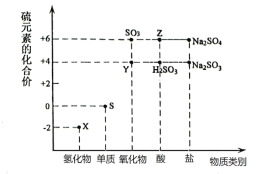
题目内容
【题目】已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
A.该反应中的H2SO4只体现酸性,不体现氧化性
B.1molKClO3参加反应时有5mol电子转移
C.发生氧化反应与还原反应的氯元素的质量比为5:1
D.生成标准状况下22.4LCl2,则有![]() molKClO3被还原
molKClO3被还原
【答案】D
【解析】
5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,KCl中Cl元素由-1价升高到0,KClO3中Cl元素由+5价降低为0,以此来解答。
A.硫酸中各元素的化合价不变,则H2SO4既不是氧化剂又不是还原剂,故A正确;
B.1molKClO3参加反应时有1mol×(5-0)=5mol电子转移,故B正确;
C. KCl为还原剂被氧化,KClO3是氧化剂被还原,由反应可知被氧化与被还原的氯元素的质量比为5:1,故C正确;
D. KClO3是氧化剂被还原,标准状况下22.4LCl2的物质的量是1mol,根据方程式,有![]() molKClO3被还原,故D错误;
molKClO3被还原,故D错误;
答案选D。

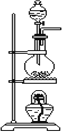
【题目】某实验小组设计用50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液在如图装置中进行中和反应。试回答下列问题:
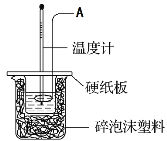
(1)仪器A的名称__________________________
(2)实验过程中下列操作正确是______________(填字母)。
A.用温度计小心搅拌
B.分多次加入氢氧化钠溶液
C.只进行一次实验,用所获得的数据计算中和热
D.用套在温度计上的A轻轻地上下搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
(4)以下操作,会使测得的中和热ΔH发生怎样的变化?(填“偏大”“偏小”或“不变”)。
①量取稀盐酸时俯视量筒读数,测得的中和热ΔH会_______________ 。
②在中和热测定实验中未用水洗涤温度计上的盐酸直接测定碱的温度,测得的中和热ΔH会_______________。
③若用等浓度的醋酸与 NaOH 溶液反应,则测得的中和热ΔH会 __________,其原因是____________________________________________________________________________。
【题目】浓硫酸与木炭粉在加热条件下反应:C+H2SO4(浓)![]() CO2↑+SO2↑+2H2O
CO2↑+SO2↑+2H2O
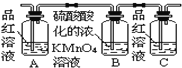
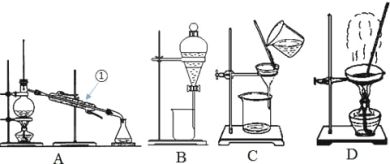
Ⅰ.第一小组用如图所示各装置设计一个实验,验证上述反应所产生的三种产物。
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(1)这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):④→ → → 。___
(2)实验时可观察到装置A瓶的溶液褪色,C瓶的溶液不褪色;A瓶溶液变化体现了SO2___性;B瓶溶液的作用是___,B瓶中对应反应的离子方程式是___;C瓶溶液的作用是___。
(3)装置②中看到现象是___。
(4)装置③中所加试剂名称是___,现象是___。
Ⅱ.另一个小组为测得CO2和SO2的质量,并计算两者物质的量之比,设计下列实验:
将生成气体依次通过X溶液→浓硫酸→碱石灰1→碱石灰2,并设法让气体完全被吸收。
(5)下列试剂中适合充当X的是___
A.BaCl2溶液 B.Ba(OH)2溶液
C.滴加H2O2的BaCl2溶液 D.滴加H2O2的Ba(OH)2溶液
(6)实验结束后,在X溶液中得到的沉淀通过过滤、洗涤、烘干、称重,称得质量为4.66g。称得碱石灰1(足量)在实验前后增重质量为1.32g。CO2和SO2物质的量比___。