题目内容
8.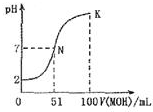 常温下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计).下列说法中不正确的是
常温下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计).下列说法中不正确的是( )
| A. | MOH为一元弱碱 | |
| B. | MA 稀溶液PH<7 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液的PH=10,则C(MOH)+C(OH)-C(H+=0.01mol•L-1 |
分析 0.01mol•L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,根据物料守恒计算K点c(MOH)和c(M+)的和.
A.根据0.01mol/L的HA溶液的pH=2可知,HA在溶液中完全电离,则HA为强电解质,恰好反应需要碱50ml,溶液呈酸性分析;
B.N点为中性溶液,而K点溶液显示碱性,氢氧根离子抑制了水电离电离,MOH的物质的量大于HA的物质的量,说明MOH是弱碱;
C.由图象可知,N点溶液呈中性,水电离的氢离子为10-7mol/l,K点溶液呈碱性,MOH电离的氢氧根离子抑制了水电离,水电离的氢离子小于10-7mol/l,所以N点水的电离程度大于K点水的电离程度;
D.根据物料守恒、电荷守恒判断溶液中c(MOH)+c(OH-)-c(H+)结果.
解答 解:A.0.01mol•L-1 HA溶液中pH=2,则HA是强酸,5ml碱溶液恰好反应后,溶液呈酸性,51ml恰好溶液呈中性,说明碱为弱碱,故A正确;
B.HA是强酸,碱为弱碱,MA是强酸弱碱盐,其稀溶液PH<7,故B正确;
C.由图象可知,N点溶液呈中性,水电离的氢离子为10-7mol/l,K点溶液呈碱性,MOH电离的氢氧根离子抑制了水电离,水电离的氢离子小于10-7mol/l,所以N点水的电离程度大于K点水的电离程度,故C正确;
D.在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)+c(M+)=0.01mol•L-1,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),c(MOH)+c(OH-)-c(H+)=c(M+)-c(A-)+c(MOH)=0.01mol•L-1-0.005mol•L-1=0.005mol•L-1,故D错误;
故选D.
点评 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点,题目难度中等.

 阶梯计算系列答案
阶梯计算系列答案| A. | 在丙烯醛分子中,仅含有一种官能团 | |
| B. | 丙烯醛能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯醛能发生加聚反应,生成高聚物 | |
| D. | 等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2 |
| A. | 液态溴化氢 | B. | 液氨 | C. | 铝 | D. | 稀硝酸 |
(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ.写出该反应的热化学方程式:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol.
已知常温下NO与O2反应生成1molNO2的焓变为-57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为-46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式②4NO(g)+3O2(g)+2H2O(g)=4HNO3(aq)△H=-618.42KJ/mol,.
(3)某温度下纯水中的c(H+)=2×10-7mol/L,则此时c(OH-)=2×10-7mol/L,该纯水的pH<7(填“>7”、“<7”、“=7”).若温度不变,滴入稀硫酸使c(H+)=5×10-6mol/L,则c(OH-)=8×10-9mol/.
(4)(3分)纳米MgO可用于尿素与氯化镁合成.某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究温度对产率的影响 实验②和③探究反应时间对产率的影响 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | 4:1 | |
| ④ | 398 | 4 | 4:1 |
| A. | 四种元素的原子半径由小到大的顺序为:r(X)<r(Z)<r(W)<r(Y). | |
| B. | X、Y、Z既能形成离子化合物,又能形成共价化合物 | |
| C. | X与其余三种元素之间形成的核外电子总数为10的微粒只有2种 | |
| D. | H2Z的熔点比H2W高,是因为它们的晶体类型不同 |
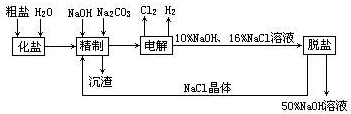
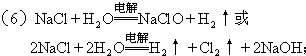 .
.
 ,二氯化二硫(S2Cl2)所属的晶体类型分子晶体.
,二氯化二硫(S2Cl2)所属的晶体类型分子晶体.