题目内容
15.25℃时,有c(CH3COOH)+c(CH3COO-)=0.2mol.L-1的一组醋酸与醋酸钾的混合溶液,溶液中的c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关说法正确的是( )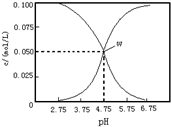
| A. | 该温度下醋酸的电离平衡常数为ka=10-4.75 | |
| B. | pH=6的溶液中,c(K+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L | |
| C. | pH=3.75的溶液中c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 向W点所示溶液中通入0.1molHCl气体(溶液体积可以忽略不计)c(H+)=c(OH-)+c(CH3COOH) |
分析 由图象可看出,随pH的增大浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),X点时c(CH3COOH)=c(CH3COO-),结合溶液的电荷守恒、物料守恒解答该题.
解答 解:A.在W点,c(CH3COOH)=c(CH3COO-),电离平衡常数为k=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$=c(H+)=10-4.75 mol•L-1,故A正确;
B.c(K+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.2mol•L-1代入即可得c(K+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COOH)+c(CH3COO-)=0.2mol•L-1,故B错误;
C.根据图知,pH=3.75时,c(CH3COOH)>c(CH3COO-),故C错误;
D.根据质子守恒得c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选A.
点评 本题考查离子浓度大小比较,明确溶液中存在的盐类水解、原子守恒和物料守恒是解本题关键,侧重考查学生分析判断、计算及识图能力,题目难度中等.

练习册系列答案
相关题目
5.已知反应A(g)+3B(g)?2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
3.如图所示的装置可用于( )


| A. | 加热NaHCO3制CO2 | B. | 用Cu与稀硝酸反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用锌与稀硫酸反应制H2 |
10.由一种阳离子与两种酸根离子组成的盐称为混盐.混盐Na4S2O3,在酸性条件下可以产生S.下列关于混盐
Na4S2O3的有关判断不正确的是( )
Na4S2O3的有关判断不正确的是( )
| A. | 该混盐的水溶液呈碱性 | |
| B. | 该混盐溶液中加人BaCl2溶液,可以生成白色沉淀 | |
| C. | 该混盐与稀硫酸反应产生1mol S时转移2NA个电子 | |
| D. | 该混盐中的硫元素的化合价为-2和+4 |
 硼及其化合物的研究在无机化学的发展中占有独特的地位.
硼及其化合物的研究在无机化学的发展中占有独特的地位. H++B(OH)4-
H++B(OH)4-
 (注:R、R′为径基).A为有机合成中间体,可发生银镜反应.A在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
(注:R、R′为径基).A为有机合成中间体,可发生银镜反应.A在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.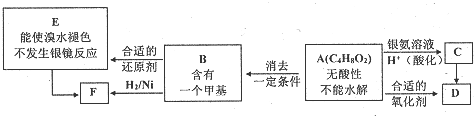
 或
或 .
. .
.