题目内容
 甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁
甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁
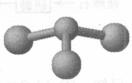
(1)若甲为块状固体,丙分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式______.
(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式______.
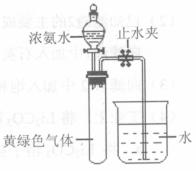
(3)霍夫曼用上述反应测定了氨分子的组成.用图3装置实验,打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至 处.滴加浓氨水后试管内的现象:______反应化学方程式:______
处.滴加浓氨水后试管内的现象:______反应化学方程式:______
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式______,反应方程式______.
解:(1)丙分子内同时具有极性键和非极性键可燃性气体,应为C2H2,为直线形分子,结构式为H-C≡C-H,故答案为:H-C≡C-H;
(2)甲和丁是同主族元素组成的单质,乙为水,发生置换反应,生成气体为H2或O2,甲的组成元素位于第三周期,只有
Na与水反应生成H2符合,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)打开止水夹,试管内液面上升至 处,说明生成气体为原来气体的
处,说明生成气体为原来气体的 ,即n(Cl2):n(N2)=3:1,则反应的方程式为
,即n(Cl2):n(N2)=3:1,则反应的方程式为
8NH3+3Cl2=N2+6NH4Cl,随着反应的进行,黄绿色气体逐渐消失,并生成大量白烟,
故答案为:产生大量白烟,黄绿色气体消失;8NH3+3Cl2=N2+6NH4Cl;
(4)n(Cl2)= =0.3mol,氮的氯化物为0.1mol,设生成物的化合价为x,根据氧化剂和还原剂得失电子数目相等,则有0.3mol×2=0.1mol×[x-(-3)],x=3,所以生成物为NCl3,反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,
=0.3mol,氮的氯化物为0.1mol,设生成物的化合价为x,根据氧化剂和还原剂得失电子数目相等,则有0.3mol×2=0.1mol×[x-(-3)],x=3,所以生成物为NCl3,反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,
故答案为:NCl3;3Cl2+NH4Cl═NCl3+4HCl.
分析:(1)丙分子内同时具有极性键和非极性键可燃性气体,应为C2H2;
(2)甲和丁是同主族元素组成的单质,乙为水,发生置换反应,生成气体为H2或O2,甲的组成元素位于第三周期,只有Na与水反应生成H2符合;
(3)打开止水夹,试管内液面上升至 处,说明生成气体为原来气体的
处,说明生成气体为原来气体的 ,即n(Cl2):n(N2)=3:1,根据质量守恒书写反应的化学方程式;
,即n(Cl2):n(N2)=3:1,根据质量守恒书写反应的化学方程式;
(4)n(Cl2)= =0.3mol,根据电子守恒判断反应物,并书写化学方程式.
=0.3mol,根据电子守恒判断反应物,并书写化学方程式.
点评:本题考查无机物的推断,题目难度中等,本题易错点为化学方程式的书写,注意从守恒的角度解答.
(2)甲和丁是同主族元素组成的单质,乙为水,发生置换反应,生成气体为H2或O2,甲的组成元素位于第三周期,只有
Na与水反应生成H2符合,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)打开止水夹,试管内液面上升至
 处,说明生成气体为原来气体的
处,说明生成气体为原来气体的 ,即n(Cl2):n(N2)=3:1,则反应的方程式为
,即n(Cl2):n(N2)=3:1,则反应的方程式为8NH3+3Cl2=N2+6NH4Cl,随着反应的进行,黄绿色气体逐渐消失,并生成大量白烟,
故答案为:产生大量白烟,黄绿色气体消失;8NH3+3Cl2=N2+6NH4Cl;
(4)n(Cl2)=
 =0.3mol,氮的氯化物为0.1mol,设生成物的化合价为x,根据氧化剂和还原剂得失电子数目相等,则有0.3mol×2=0.1mol×[x-(-3)],x=3,所以生成物为NCl3,反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,
=0.3mol,氮的氯化物为0.1mol,设生成物的化合价为x,根据氧化剂和还原剂得失电子数目相等,则有0.3mol×2=0.1mol×[x-(-3)],x=3,所以生成物为NCl3,反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,故答案为:NCl3;3Cl2+NH4Cl═NCl3+4HCl.
分析:(1)丙分子内同时具有极性键和非极性键可燃性气体,应为C2H2;
(2)甲和丁是同主族元素组成的单质,乙为水,发生置换反应,生成气体为H2或O2,甲的组成元素位于第三周期,只有Na与水反应生成H2符合;
(3)打开止水夹,试管内液面上升至
 处,说明生成气体为原来气体的
处,说明生成气体为原来气体的 ,即n(Cl2):n(N2)=3:1,根据质量守恒书写反应的化学方程式;
,即n(Cl2):n(N2)=3:1,根据质量守恒书写反应的化学方程式;(4)n(Cl2)=
 =0.3mol,根据电子守恒判断反应物,并书写化学方程式.
=0.3mol,根据电子守恒判断反应物,并书写化学方程式.点评:本题考查无机物的推断,题目难度中等,本题易错点为化学方程式的书写,注意从守恒的角度解答.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
 (2011?怀柔区模拟)甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁
(2011?怀柔区模拟)甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁 甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.
甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系. (2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
 甲、乙、丙、丁是由短周期元素组成的四种物质,它们之间存在如下转化关系:甲+乙→丙+丁
甲、乙、丙、丁是由短周期元素组成的四种物质,它们之间存在如下转化关系:甲+乙→丙+丁