题目内容
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
(1)水分子中氧原子在基态时核外电子排布图为 ;
(2)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
(3)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式: .
(1)水分子中氧原子在基态时核外电子排布图为
(2)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是
(3)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:
考点:原子核外电子排布,配合物的成键情况
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同是,能量最低,根据此原则,O原子核外有8个电子,据此分析解答;
(2)升华热=范德华力+氢键,利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能;
(3)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,该络合离子为平面正方形;
(2)升华热=范德华力+氢键,利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能;
(3)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,该络合离子为平面正方形;
解答:
解:(1)由于简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,原子的能量最低,O原子能量最低排布是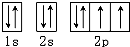 ,
,
故答案为: ;
;
(2)冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol,
故答案为:20;
(3)将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,生成此配合离子的离子方程式:Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+;
 ,
,故答案为:
 ;
;(2)冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol,
故答案为:20;
(3)将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,生成此配合离子的离子方程式:Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+;
点评:本题考查物质结构与性质,明确原子序数、电子排布等知识即可解答,注意升华热=范德华力+氢键,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 |
| B、原电池的两极一定是由活动性不同的两种金属组成 |
| C、热化学方程式中△H的值与反应物的用量有关 |
| D、化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 |
25°C时,某溶液中由水电离出的c(OH-)=1×10-13mol/L,该溶液中一定不能大量共存的离子组是( )
| A、NH4+、Fe3+、SO42-、Cl- |
| B、CO32-、SO42-、K+、Na+ |
| C、Na+、SO42-、NO3-、Cl- |
| D、SO42-、Na+、HCO3-、K+ |
CH4、NH3、H2O、HF分子中,共价键的极性由强到弱的顺序是( )
| A、CH4、NH3、H2O、HF |
| B、HF、H2O、NH3、CH4 |
| C、H2O、HF、CH4、NH3 |
| D、HF、H2O、CH4、NH3 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、电解食盐水若产生22.4L H2,则转移的电子数目为2NA |
| B、Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数约为2×6.02×1022 |
| C、标准状况下,铝跟盐酸溶液反应生成1mol氢气时,转移的电子数为2NA |
| D、1mol?L-1的Na2CO3溶液中含有NA个CO32- |
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1mol Na2O2晶体中共含有4NA个离子 |
| B、1mol OH-中含有的质子数为10NA |
| C、常温常压下,16gO2和O3混合气体含有Na个氧原子 |
| D、标准状况下,5.6L NO和5.6LO2混合后分子总数为0.5NA |
NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、用石墨电极电解氯化铜溶液时,若阴极增重64 g,则阳极能产生NA个氯气分子 |
| B、25℃,pH=1的稀硫酸中含有的H+数为0.1 NA |
| C、用石墨电极电解饱和食盐水,当阴极产生2.24 L H2时,转移的电子数一定为0.2 NA |
| D、100 mL 1 mol?L-1的NH4Cl溶液中,NH4+的数目等于0.1 NA |