题目内容
一定温度下,在容积为2L的恒容密闭容器中充入4 mol N2O3,发生反应:N2O3(g)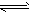 N2O(g)+O2(g);
N2O(g)+O2(g);
N2O3(g)+O2(g)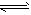 N2O5(g),达到平衡时,测得c(N2O5)为0.7 mol/L,c(O2)为0.5 mol/L,则
N2O5(g),达到平衡时,测得c(N2O5)为0.7 mol/L,c(O2)为0.5 mol/L,则
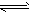 N2O(g)+O2(g);
N2O(g)+O2(g);N2O3(g)+O2(g)
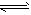 N2O5(g),达到平衡时,测得c(N2O5)为0.7 mol/L,c(O2)为0.5 mol/L,则
N2O5(g),达到平衡时,测得c(N2O5)为0.7 mol/L,c(O2)为0.5 mol/L,则 [ ]
A.c(N2O3)=0.8 mol/L
B.c(N2O3)=0.2 mol/L
C.c(N2O)=0.5 mol/L
D.c(N2O) =1.2 mol/L
B.c(N2O3)=0.2 mol/L
C.c(N2O)=0.5 mol/L
D.c(N2O) =1.2 mol/L
D

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)?(H2O)x(g),反应物和生成物的物质的量随时间变化关系如图.下列说法不正确的是( )
一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)?(H2O)x(g),反应物和生成物的物质的量随时间变化关系如图.下列说法不正确的是( )| A、x=3 | ||
| B、该温度下,反应的平衡常数为0.125L3/mol3 | ||
| C、平衡时混合气体的平均摩尔质量是33.3g/mol | ||
D、t1时刻,保持温度不变,再充入1mol H2O(g),重新达到平衡时,
|
在一定温度下,在容积为10L的密闭容器中,用2molCO和10molH2O(气)相互混合并加热到800℃时,有下列平衡:CO+H2O?CO2+H2,且平衡常数K=1,则有CO的转化率为( )
| A、16.7% | B、50% | C、66.7% | D、83.3% |
 一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)?N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)?N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答: 一定温度下,在容积为V L的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示: M
M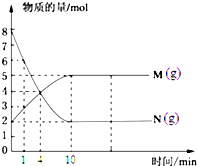 一定温度下,在容积为100L的定容密闭容器中进行某化学反应,反应体系中各组分的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为100L的定容密闭容器中进行某化学反应,反应体系中各组分的物质的量随时间的变化曲线如图所示: