题目内容
(1)人类也可主动地参与氮循环,合成氨工业就是参与的手段之一,以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多优点. 其过程大体如下:

①请写出用天然气制备氢气的化学方程式:
②写出合成尿素[CO(NH2)2]反应的化学方程式:
③写出O2与NH3反应生成NH4NO3和H2O的化学方程式:
④每生产1mol NH4NO3最少需要NH3 mol,而要生产这些NH3又最少需要CH4 mol.
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图2).已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为N2时要释放 kJ能量.

①请写出用天然气制备氢气的化学方程式:
②写出合成尿素[CO(NH2)2]反应的化学方程式:
③写出O2与NH3反应生成NH4NO3和H2O的化学方程式:
④每生产1mol NH4NO3最少需要NH3
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图2).已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为N2时要释放
考点:工业合成氨,反应热和焓变
专题:化学应用
分析:(1)①根据工艺流程示意图可知CH4的转化为CO2和H2;②根据二氧化碳和氨气反应生成尿素;③根据原子守恒写出O2与NH3反应生成NH4NO3和H2O的化学方程式;④根据氮原子守恒回答;
(2)从结构图中可看出,一个N4分子中含有6个N-N键,根据反应热等于反应物的总键能减生成物的总键能计算.
(2)从结构图中可看出,一个N4分子中含有6个N-N键,根据反应热等于反应物的总键能减生成物的总键能计算.
解答:
解:(1)①CH4转化过程中生成了CO2和H2,方程式为:CH4+2H2O
CO2+4H2,故答案为:CH4+2H2O
CO2+4H2;
②二氧化碳和氨气反应生成尿素,根据原子守恒:CO2+2NH3
CO(NH2)2+H2O,故答案为:CO2+2NH3
CO(NH2)2+H2O;
③O2与NH3反应生成NH4NO3,根据原子守恒反应的化学方程式为2NH3+2O2
NH4NO3+H2O,故答案为:2NH3+2O2
NH4NO3+H2O;
④NH4NO3~2NH3,每生产1mol NH4NO3最少需要2molNH3;根据反应CH4+2H2O
CO2+4H2、N2+3H2
2NH3,可知生产2molNH3需要甲烷0.75mol,
故答案为:2;0.75;
(2)从结构图中可看出,一个N4分子中含有6个N-N键,根据反应热等于反应物的总键能减生成物的总键能,则N4(g)=2N2(g)△H,有△H=6×193 kJ?mol-1-2×941 kJ?mol-1=-724 kJ?mol-1,故答案为:724.
| ||
| ||
②二氧化碳和氨气反应生成尿素,根据原子守恒:CO2+2NH3
| ||
| ||
③O2与NH3反应生成NH4NO3,根据原子守恒反应的化学方程式为2NH3+2O2
| ||
| ||
④NH4NO3~2NH3,每生产1mol NH4NO3最少需要2molNH3;根据反应CH4+2H2O
| ||
| ||
| 高温高压 |
故答案为:2;0.75;
(2)从结构图中可看出,一个N4分子中含有6个N-N键,根据反应热等于反应物的总键能减生成物的总键能,则N4(g)=2N2(g)△H,有△H=6×193 kJ?mol-1-2×941 kJ?mol-1=-724 kJ?mol-1,故答案为:724.
点评:本题是一道化学和工业生成相结合的题目,涉及到氧化还原反应、方程式的书写、电解原理、反应热的计算,考查学生分析和解决问题的能力,难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、mol是物质的质量的单位 |
| B、mol是物质的量的单位 |
| C、阿伏加德罗常数没有单位 |
| D、摩尔质量的不是物理量,所以没有单位 |
 如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )| A、D中可能是浓硫酸 |
| B、通入的氯气含有水蒸气 |
| C、D中可能是水 |
| D、D中不可能是NaOH溶液 |
 )
)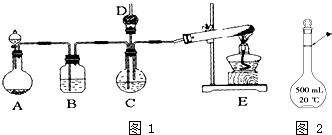 纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图1所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图1所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去. 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途. 根据中和热的测定实验填空.
根据中和热的测定实验填空.