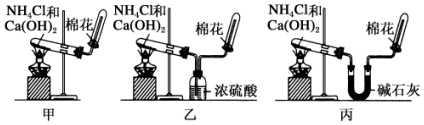
题目内容
19.一定量的 KMnO4 与足量的 250mL 浓盐酸反应,方程式为:2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O,反应结束后,共转移电子为 0.5mol,则盐酸减少的物质的量浓度为(溶液的体积变化忽略不计)( )| A. | 1mol/L | B. | 2mol/L | C. | 3.2mol/L | D. | 4mol/L |
分析 氧化还原反应中,根据化合价的升降确定生成的还原产物以及物质的量,根据公式c=$\frac{n}{V}$计算即可.
解答 解:2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O,反应中Mn元素的化合价从+7降低到+2价,反应共转移电子0.5mol,消耗0.1molKMnO4,消耗HCl为0.8mol,盐酸减少的物质的量浓度为$\frac{0.8mol}{0.25L}$=3.2mol/L.
故选C.
点评 本题考查了氧化还原反应,题目难度不大,注意从化合价的角度分析氧化还原反应,明确电子转移的情况及物质的量浓度的计算是解题的关键.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
7.下列判断合理的是( )
①硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③碱性氧化物一定是金属氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥稀释浓H2SO4时,将水慢慢倒入浓H2SO4中,并不断搅拌.
①硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③碱性氧化物一定是金属氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥稀释浓H2SO4时,将水慢慢倒入浓H2SO4中,并不断搅拌.
| A. | 只有②④⑥ | B. | 只有③④⑥ | C. | 只有①③⑤ | D. | 只有①②③⑤ |
14.2015 年获得诺贝尔生理学或医学奖的是( )
| A. | 莫言 | B. | 韩寒 | C. | 屠呦呦 | D. | 鲍勃•迪伦 |
11.同温同压下,等质量的下列气体所占有的体积最大的是( )
| A. | O2 | B. | N2 | C. | CO2 | D. | SO2 |
9.下列有关硅的叙述中,正确的是( )
| A. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| B. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| C. | SiO2是酸性氧化物,能与水反应生成硅酸 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |

 →
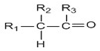
→
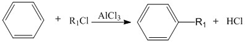
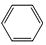 +R1Cl$\stackrel{AlCl_{3}}{→}$
+R1Cl$\stackrel{AlCl_{3}}{→}$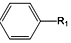 +HCl
+HCl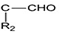 +H2O(R1、R2、R3代表烃基或氢原子)回答下列问题:
+H2O(R1、R2、R3代表烃基或氢原子)回答下列问题: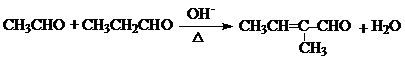 .
.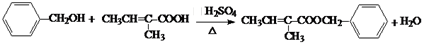 .
.