题目内容
13.下列反应过程能量的变化符合图示的是( )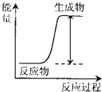
| A. | H+H→H-H | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O | |
| D. | H2SO4+2KOH═K2SO4+2H2O |
分析 生成物具有的总能量高于反应物具有的总能量,该反应为吸热反应;常见的吸热反应:C(s)+H2O(g)→CO(g)+H2O; C+CO2→CO的反应,Ba(OH)2•8H2O与NH4Cl的反应以及KClO3、KMnO4、CaCO3的分解等.
解答 解:A.新键的形成是发热过程,故A错误;
B.镁和盐酸反应是放热反应属于氧化还原反应放热,故B错误;
C.Ba(OH)2•8H2O与NH4Cl的反应是吸热反应,故C正确;
D.酸与碱的中和反应是放热反应,故D错误;
故选C.
点评 本题考查化学反应的热量变化,难度不大,学生应注重归纳中学化学中常见的吸热或放热的反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.已知I-、Fe2+、SO2、Cl-、H2O2在酸性溶液中的还原性强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,试判断下列反应不可能发生的是( )
| A. | H2O2+SO2═H2SO4 | B. | I2+2Fe2+═2I+2Fe3+ | ||
| C. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | D. | SO2+2H2O+I2═H2SO4+2HI |
8.如图立方烷(C8H8)的球棍模型,下列有关说法不正确的是( )
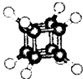

| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有三种同分异构体 | |
| C. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 | |
| D. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 |
18.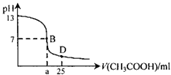 如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )
如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )
 如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )
如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )| A. | NaOH溶液起始浓度为0.1mol•L-1 | |
| B. | a>12.5 | |
| C. | B点溶液中c(Na+)一定等于c(CH3COO-) | |
| D. | D点溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
16.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA | |
| C. | 标准状况下,11.2L苯中含有的碳碳双键数为1.5NA | |
| D. | 5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
 用如图所示的实驗装置制备少置乙酸乙酯.请回答有关问题:
用如图所示的实驗装置制备少置乙酸乙酯.请回答有关问题: CH3COOC2H5+H2O,反应类型是酯化反应(或取代反应).
CH3COOC2H5+H2O,反应类型是酯化反应(或取代反应).