题目内容
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是
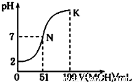
A.HA为一元强酸,MOH为一元强碱
B.N点水的电离程度小于K点水的电离程度
C.K点所示溶液中c(A-)>c(M+)
D.K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L
D
【解析】
试题分析:A、由图像分析知0.01mol/L HA的溶液PH=2,是强酸,加入碱的体积为51mL时溶液呈中性,若碱为强碱则加入碱50mL时恰好完全反应,此时为强碱强酸盐,溶液应呈中性,与图像不符,所以酸应为强酸,碱为弱碱。错误;B、N点时,溶液呈中性,氢离子浓度等于氢氧根离子浓度=1×10-7mol/L,而K点时碱过量,抑制水的电离,所以N点水的电离程度大于K点水的电离程度,错误;C、K点溶液是MOH与MA的混合液,且二者的浓度相等,但溶液呈碱性,MOH的电离程度大于M+的水解程度,则c(M+)>c(A-),错误;D、在K点时加入碱的体积为100mL,此时溶液是MOH与MA等浓度的混合液且浓度都为0.005mol/L,根据物料守恒得c(MOH)+c(M+)=0.01mol/L,正确。
考点:考查图像分析能力,酸碱混合液中守恒规律的应用,水的电离程度。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案(12分)工业制氢气的一个重要反应是:CO(g)+H2O(g)  CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
CO | H2O | H2 | CO2 | |||
I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
II | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
①对于反应CO(g)+H2O(g)  CO2(g)+H2(g),下列说法正确的是
CO2(g)+H2(g),下列说法正确的是
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率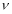 (CO)= ;
(CO)= ;
③实验II条件下反应的平衡常数K= (保留小数点后二位);H2O(g)的平衡转化率为 。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向 方向移动(填“正反应”、“逆反应”或“不移动”)
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是 。
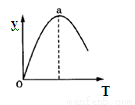
A.CO2的百分含量 B.混合气体的平均相对分子质量
C.CO的转化率 D.H2O的物质的量
 的命名正确的是:
的命名正确的是: ,则阿伏加德罗常数可表示为
,则阿伏加德罗常数可表示为 B.
B. C.
C. D.
D.
