题目内容
14.把100毫升、2摩/升的NaOH溶液,100毫升、2摩/升的H2SO4溶液以及一定量的氨水混合,所得的溶液使酚酞试液显浅红色,则溶液中离子浓度关系正确的是( )| A. | C(SO42-)=C(Na+)>C(NH4+)>C(OH-)>C(H+) | B. | C(Na+)>C(SO42-)>C(NH4+)>C(OH-)>C(H+) | ||
| C. | C(NH4+)>C(SO42-)=C(Na+)>C(H+)>C(OH-) | D. | C(H+)+C(NH4+)+C(Na+)=C(OH-)+2C(SO42-) |
分析 100mL、2mol/L的NaOH溶液,100mL、2mol/L的H2SO4溶液以及一定量的氨水混合,其中含有0.2molNaOH,0.2molH2SO4,和一定量的氨水,所得的溶液使酚酞试液显浅红色,表明溶液呈碱性,0.2molNaOH和0.2molH2SO4反应后,溶液中存在0.2molNa+,0.2molH+,0.2molSO42-,过量的H+与一定量氨水反应,生成NH4+,溶液中一定剩余NH3•H2O,结合溶液中的守恒思想分析判断.
解答 解:100mL、2mol/L的NaOH溶液,100mL、2mol/L的H2SO4溶液以及一定量的氨水混合,其中含有0.2molNaOH,0.2molH2SO4,和一定量的氨水,所得的溶液使酚酞试液显浅红色,表明溶液呈碱性,0.2molNaOH和0.2molH2SO4反应后,溶液中存在0.2molNa+,0.2molH+,0.2molSO42-,过量的H+与一定量氨水反应,生成NH4+,溶液中一定剩余NH3•H2O,
溶液中存在电荷守恒,c(Na+)+c(H+)+c(NH4+)=c(OH-)+2c(SO42-),有物料守恒,c(Na+)=c(SO42-),综合考虑,则有关系:c(H+)+c(NH4+)=c(OH-)+c(SO42-),
A.0.2molNaOH和0.2molH2SO4反应后,溶液中存在0.2molNa+,0.2molH+,0.2molSO42-,过量的H+与一定量氨水反应,生成NH4+,溶液中一定剩余NH3•H2O,溶液呈碱性,则c(OH-)>c(H+),根据关系式:c(H+)+c(NH4+)=c(OH-)+c(SO42-),则c(NH4+)>c(SO42-),故A错误;
B.溶液中存在0.2molNa+,0.2molH+,0.2molSO42-,因此溶液中c(Na+)=c(SO42-),故B错误;
C.根据关系式:c(H+)+c(NH4+)=c(OH-)+c(SO42-),溶液为碱性,则c(OH-)>c(H+),所以c(NH4+)>c(SO42-),故C错误;
D.根据电荷守恒,c(Na+)+c(H+)+c(NH4+)=c(OH-)+2c(SO42-),故D正确.
故选D.
点评 本题考查离子浓度大小的比较,根据物质的量计算经过反应后溶液中的组分情况是关键,牢牢把握溶液中的守恒思想,题目难度不大.

 阅读快车系列答案
阅读快车系列答案
| A. | 5个 | B. | 6个 | C. | 7个 | D. | 8个 |
| A. | 3:1 | B. | 1:3 | C. | 3:2 | D. | 2:3 |
| A. | 通式相同的两种有机物,其实验式也相同 | |
| B. | 等质量且通式相同的两种有机物完全燃烧耗氧量未必相同 | |
| C. | 通式相同的两种有机物要么互为同系物要么互为同分异构 | |
| D. | 实验式相同的两种有机物要么互为同系物要么互为同分异构 |
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | B. | Y、W的最简单氢化物能相互反应 | ||
| C. | 非金属性:Z<W | D. | X、Z、W形成的化合物均为强酸 |
| A. | CH2BrCH2CH2CH2Br | B. | CH3CH2CH2CH2Br | ||
| C. | CH3CHBrCHBrCH3 | D. | CH3Br |
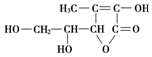
| A. | 易发生氧化及加成反应 | B. | 在碱性溶液中能稳定地存在 | ||
| C. | 能与乙酸发生酯化反应 | D. | 是一个环状的酯类化合物 |
| A. | 开始加入合金的总物质的量为0.3mol | |
| B. | 生成的气体在标准状况下大于4.48L | |
| C. | 所加NaOH溶液体积为150mL | |
| D. | 原硝酸浓度为6mol•L-1 |