题目内容
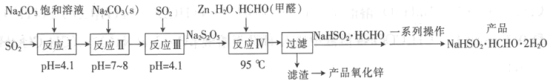
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
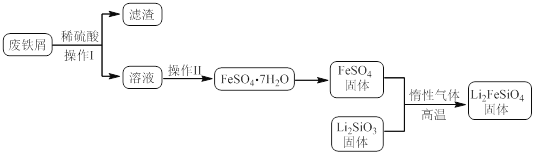
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
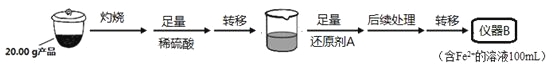
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。
【答案】(1)100mL容量瓶;酸式滴定管(2)防止二价铁被氧化(3)蒸发浓缩,冷却结晶,过滤;玻璃棒(4)SO2+2Fe3++2H2O==2Fe2++SO42-+4H+ ;除去过量的SO2,以免影响后面Fe2+的测定(5)溶液变为浅红色,且半分钟内不变色;81%;偏高
【解析】试题分析:(1)实验二中仪器B为配制溶液需要的容量瓶,得到含Fe2+离子的溶液100ml,需要仪器为100ml容量瓶,仪器C为滴定实验所用的标准溶液,标准溶液为高锰酸钾溶液具有氧化性能腐蚀橡胶管,需要盛放在酸式滴定管中,故答案为:100ml容量瓶,酸式滴定管;
(2)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,因为亚铁离子具有还原性,易被氧化,所以惰性气体氛围中是为了防止亚铁离子被氧化,故答案为:防止二价铁被氧化;
(3)操作Ⅱ是溶液中得到硫酸亚铁晶体的实验操作,蒸发浓缩,降温结晶,过滤洗涤得到;操作Ⅰ是分离固体和溶液的方法需要过滤,结合过滤装置选择仪器有普通漏斗、烧杯、玻璃棒,故答案为:蒸发浓缩,降温结晶,过滤;玻璃棒;
(4)还原剂A可用SO2,二氧化硫具有还原性被铁离子氧化为硫酸,反应的离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时后续操作应除去过量的SO2以免影响后面Fe2+的测定,故答案为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;除去过量的SO2,以免影响后面Fe2+的测定;
(5)滴定实验反应终点的判断是依据高锰酸钾溶液滴入最后一滴溶液呈浅红色且半分钟不变化,从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000molLˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.消耗高锰酸钾溶液体积第3次误差较大舍去,计算平均消耗溶液体积,结合离子反应的定量关系计算,V(标准)=![]() ml=20.00ml,铁元素守恒计算
ml=20.00ml,铁元素守恒计算
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
5Li2FeSiO4~5Fe2+~MnO4-,
5 1
n 0.2000mol/L×0.020L
n=0.0200mol
100ml溶液中含物质的量=0.0200mol×![]() =0.1000mol,
=0.1000mol,
产品中Li2FeSiO4的质量分数=![]() ×100%=81%,
×100%=81%,
滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,会造成V(标准)偏大,会造成c(待测)偏高,
故答案为:溶液变为浅红色,且半分钟内不变色;81%;偏高;

【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
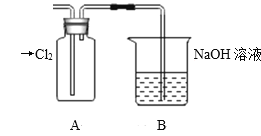
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。