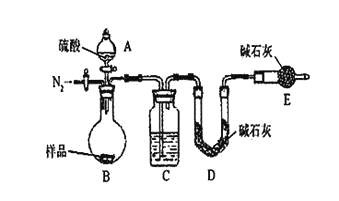
题目内容
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
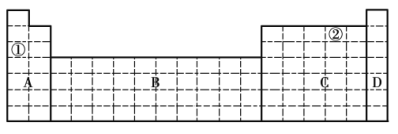
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
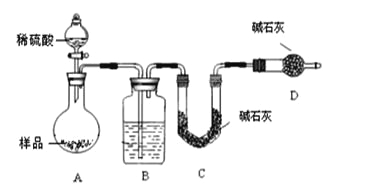
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
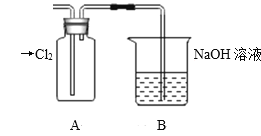
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。
【答案】X>Z>Y A B Cl2+Na2S=2NaCl+S↓ B 变蓝 原子半径递增,得电子能力递减
【解析】
I.金属越活泼,与水或酸反应置换出氢气越容易;
根据同一周期的元素,原子序数越大,原子的最外层电子数越多,原子半径越小,元素的最高价氧化物对应的水化物的碱性越弱分析判断;
II. (1)要验证Cl的非金属性比S强,可通过单质之间的置换反应判断;
(2)根据判断元素非金属性强弱的方法进行判断;
(3)活动性强的可以将活动性弱的置换出来,结合碘单质遇淀粉溶液变为蓝色判断;同一主族元素从上到下原子半径逐渐增大,原子获得电子的能力逐渐减弱。
I.根据实验1可知X、Z与水混合,金属X与水反应比金属Z剧烈,说明金属活动性X>Z;根据实验2:等质量的金属Z和金属Y分别加入到5mL1.0mol/L盐酸中,金属Z与盐酸反应比金属Y剧烈,说明金属活动性Z>Y,故三种金属活动性X>Z>Y;
A.同一周期的元素,原子序数越大,原子半径越小,金属活动性越弱,所以原子序数:X<Z<Y;A正确;
B.同一周期的元素,原子最外层电子数越多,原子半径越小,元素的金属性越弱,所以三种元素的原子的最外层电子数X<Z<Y,B错误;
C.同一周期的元素,原子最外层电子数越多,原子半径越小,元素的金属性越弱,由元素的金属性X>Z>Y,可知原子半径:Y<Z<X,C错误;
D.Y的金属性最弱,所以Y的最高价氧化物对应水化物的碱性最弱,D错误;
故合理选项是A;
II. (1) A.Cl2可以与Na2SO3溶液反应产生HCl、Na2SO4,但不能判断Cl与S非金属性强弱,A错误;
B.Na2S溶液与Cl2发生反应:Cl2+Na2S=2NaCl+S↓,会看到溶液中产生淡黄色浑浊,因此可以证明元素的非金属性Cl>S,B正确;
C.Cl2与Na2SO4溶液不能反应,无明显现象,不能判断Cl与S非金属性强弱,C错误;
故合理选项是B;
(2)A.元素的非金属性越强,其相应的氢化物稳定性越强,根据HCl比H2S稳定可知元素的非金属性Cl>S,A不符合题意;
B.HClO氧化性比H2SO4强,与元素的非金属性强弱无关,B符合题意;
C.元素的非金属性越强,其最高价含氧酸的酸性越强,由于HClO4酸性比H2SO4强,可知元素的非金属性Cl>S,C不符合题意;
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS,说明Cl2的氧化性比S强,从而可证明元素的非金属性Cl>S,D不符合题意;
故合理选项是B;
(3)活动性强的可以将活动性弱的置换出来,将Cl2通入KI淀粉溶液中,发生反应:Cl2+2KI=2KCl+I2,I2遇淀粉溶液变为蓝色;Cl元素的非金属性比I强是由于同主族元素从上到下,原子半径递增,得电子能力递减,故单质的氧化性逐渐减弱,元素的非金属性逐渐减弱。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
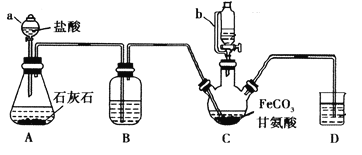
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
(2)反应①的化学平衡常数K表达式为________;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是________。
图1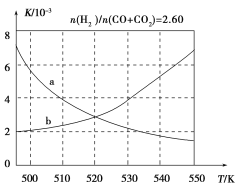
图2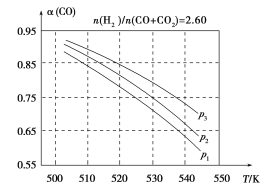
(3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是________________________________;图2中的压强由大到小为________,其判断理由是____________。
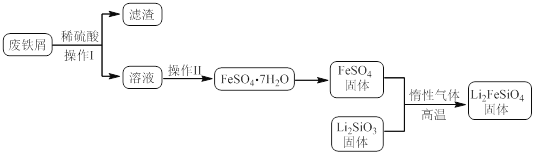
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
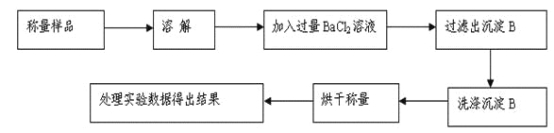
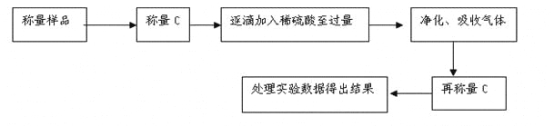
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
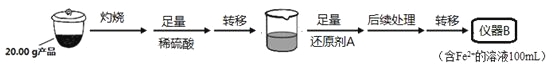
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。