题目内容
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为__,该能层上具有的原子轨道数为__,电子数为__。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?__(填“是”或“否”)。
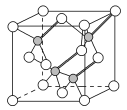
(3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如图所示(白色球代表As原子)。在GaAs晶体中,每个Ga原子与__个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为__。
(4)与As同主族的短周期元素是N、P。AsH3中心原子杂化的类型__;一定压强下将AsH3和NH3、PH3的混合气体降温时首先液化的是__,理由是__。
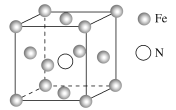
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为__;设晶胞边长为acm,阿伏加德罗常数的值为NA,该晶体的密度为__g·cm-3(用含a和NA的式子表示)。
【答案】N 16 1 否 4 正四面体 sp3 NH3 因为氨分子间存在氢键,分子间作用力更大,沸点更高,降温时先液化 Fe4N ![]()
【解析】
(1)基态Cr原子核外电子排布式为[Ar]3d54s1,电子占据最高能层为第四能层,能层符号为N;第四能层中有s、p、d、f能级,分别具有的轨道数为:1、3、5、7,轨道总数为1+3+5+7=16;由核外电子排布式可知,基态Cr原子在第四能层上的电子数为1;
(2)原子的最外层电子数处于半满或全满时,是一种稳定结构,此时原子的第一电离都高于同周期相邻的元素,30Zn的3d能级上有10个电子,4s能级有2个电子,处于全满状态,较稳定,30Zn的第一电离能大于Ga,所以30Zn与31Ga的第一电离能不符合逐渐增大的规律;
(3)根据晶胞图可知,砷化镓结构中,As位于晶胞的面心和顶点上,Ga位于由四个As原子形成的四面体的体心,所以每个Ga原子与4个As原子相连;与同一个Ga原子相连的As原子构成的空间构型为正四面体;
(4)氨分子中氮原子按sp3方式杂化,N与As同主族,所经AsH3的结构与NH3相似,AsH3中心原子杂化的类型为sp3;NH3分子之间有氢键,沸点较高,所以一定压强下将AsH3和NH3、PH3的混合气体降温时,首先液化的是NH3;
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为![]() ,所以氮化铁的化学式Fe4N;晶胞的体积为a3cm3,所以
,所以氮化铁的化学式Fe4N;晶胞的体积为a3cm3,所以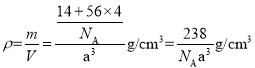 。
。

 阅读快车系列答案
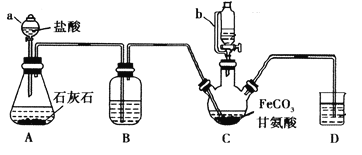
阅读快车系列答案【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
(2)反应①的化学平衡常数K表达式为________;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是________。
图1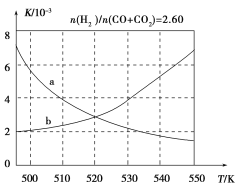
图2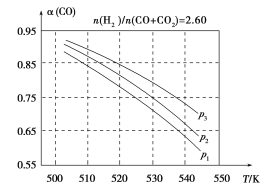
(3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是________________________________;图2中的压强由大到小为________,其判断理由是____________。
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
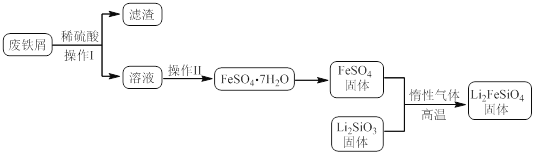
实验(二) Li2FeSiO4含量测定:
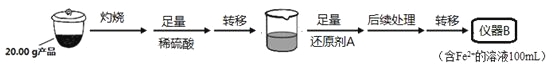
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。