题目内容
某校化学活动小组设计了下列原电池,反应完成后,Al、Zn都有剩余,试写出电极反应式,并指出电子流向。
解析:开始时,电解质为浓H2SO4,Al在浓H2SO4中钝化,Zn为负极失去电子。后来,随着反应的进行,浓H2SO4变为稀H2SO4,Al比Zn活泼,Al成为负极,失去电子。?
答案:开始阶段,负极:Zn![]() Zn2++2e-,正极:2H2SO4+2e-
Zn2++2e-,正极:2H2SO4+2e-![]() SO2↑+
SO2↑+![]() +2H2O。
+2H2O。
后来,负极:Al![]() Al3++3e-,正极:2H++2e-
Al3++3e-,正极:2H++2e-![]() H2↑。
H2↑。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
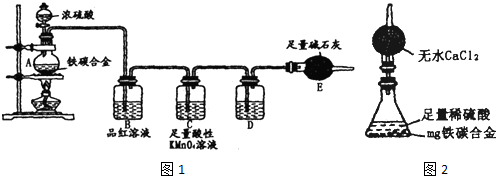


 (2011?宣城二模)某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
(2011?宣城二模)某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动: