题目内容
20.W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、4、8、8,它们的最外层电子数之和为18.下列说法错误的是( )| A. | 四种元素一定都是非金属元素 | |
| B. | 常见化合物XZ4分子中只含极性共价键 | |
| C. | 单质的沸点:W>Y | |
| D. | 最高价氧化物的水化物的酸性:Y<Z |
分析 W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、4、8、8,则W是H元素,X是C元素,Y、Z为第三周期元素;它们的最外层电子数之和为18,W最外层电子数是1,X最外层电子数是4,Y、Z最外层电子数之和是13,且二者都是主族元素,Y原子序数小于Z,则Y是S元素、Z是Cl元素,据此进行解答.
解答 解:W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、4、8、8,则W是H元素,X是C元素,Y、Z为第三周期元素;它们的最外层电子数之和为18,W最外层电子数是1,X最外层电子数是4,Y、Z最外层电子数之和是13,且二者都是主族元素,Y原子序数小于Z,则Y是S元素、Z是Cl元素,
A.根据分析可知,四种元素都是非金属元素,故A正确;
B.XZ4为CCl4,四氯化碳分子中的含有的C-Cl键为极性键,故B正确;
C.H元素单质是分子晶体,C的单质为石墨或金刚石,则W的单质的沸点小于Y,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P<Cl,最高价氧化物的水化物酸性H3PO4<HClO4,故D正确;
故选C.
点评 本题考查原子结构和元素性质,为高频考点,题目难度中等,正确判断元素是解本题关键,结合物质的结构性质解答,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
10.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 | |
| D. | 苯(苯酚):加浓溴水,静置后,过滤 |
11.在pH=1的无色溶液中能大量共存的离子组是( )
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、I-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、AlO2- |
8.在2HCHO+NaOH(浓)→HCOONa+CH3OH中的HCHO(甲醛)?( )
| A. | 仅被氧化 | B. | 未被氧化,未被还原 | ||
| C. | 仅被还原 | D. | 既被氧化,又被还原 |
5.下列物质的电子式正确的是( )
| A. | NaCl  | B. | HCl  | C. | MgBr2  | D. | NaOH  |
12.下列反应属于吸热反应的是( )
| A. | Fe片与稀H2SO4的反应 | B. | Ba(OH)2•8H2O和NH4Cl反应 | ||
| C. | 盐酸和氢氧化钠的反应 | D. | 镁条在空气中的燃烧 |
9.日本核电站泄漏事故后,人们纷纷抢购碘酒、含碘制剂、海藻类食品、红酒以及放射性测量计.核放射性物质中包括碘131和铯137.碘131一旦被人体吸入,可能会引发甲状腺疾病.下列有关${\;}_{53}^{131}$I叙述不正确的是( )
| A. | ${\;}_{53}^{131}$I是一种核素 | |
| B. | ${\;}_{53}^{131}$I核内的中子数为78 | |
| C. | ${\;}_{53}^{131}$I是碘的一种同素异形体 | |
| D. | ${\;}_{53}^{131}$I位于元素周期表中第5周期ⅦA族 |
10.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 7.8gNa2O2固体中含离子总数为0.4NA | |
| B. | 2.0gH218O和D216O的混合物中所含中子数为NA | |
| C. | 常温下,22.4LCH4中含C-H共价键数为4NA | |
| D. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA |
 )是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
)是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:

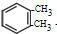 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$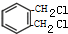 +2HCl.
+2HCl. .
. 、
、 、
、 等,所有这些同分异构体中,有6种化学环境的氢原子.
等,所有这些同分异构体中,有6种化学环境的氢原子.