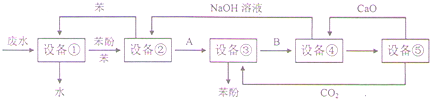
题目内容
下列变化必须加入还原剂的是( )
| A、KClO3→KCl |
| B、Cl-→Cl2 |
| C、MnO4-→Mn2+ |
| D、Fe2+→Fe3+ |
考点:氧化还原反应
专题:
分析:还原剂具有还原性,在反应中易得到电子,必须加入还原剂才能实现的反应,物质应具有氧化性,反应后所含元素的化合价降低.
解答:
解:A.Cl元素化合价降低,但无需加入还原剂,可加热分解,故A错误;
B.Cl元素化合价升高,被氧化,应加入氧化剂,故B错误;
C.Mn元素化合价降低,被还原,应加入还原剂,故C正确;
D.Fe元素化合价升高,被氧化,应加入氧化剂,故D错误.
故选C.
B.Cl元素化合价升高,被氧化,应加入氧化剂,故B错误;
C.Mn元素化合价降低,被还原,应加入还原剂,故C正确;
D.Fe元素化合价升高,被氧化,应加入氧化剂,故D错误.
故选C.
点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握氧化还原反应的实质和特征,注意元素化合价的变化.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、FeCl3、Al2(SO4)3、(NH4)2SO4六种溶液,这种试剂是( )
| A、Ba(OH)2 |
| B、NaOH |
| C、H2S |
| D、AgNO3 |
食品包装袋中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
| A、脱氧过程是吸热反应映,可降低温度,延长糕点保质期 |
| B、脱氧过程中铁作原电池负极,电极反应为:Fe-3e-═Fe3+ |
| C、脱氧过程中碳做原电池正极,电极反应为:O2+4 e-+4H+═2H2O |
| D、含有2.24g铁粉的脱氧剂,理论上最多能吸收氧气672 mL(标准状况) |
根据如图,下列判断中正确的是( )
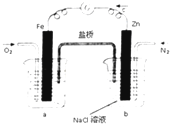

| A、烧杯a中的溶液pH减小 |
| B、烧杯b中发生氧化反应 |
| C、烧杯a中发生的反应为2H++2e-=H2↑ |
| D、烧杯b中发生的反应为2Cl--2e-=Cl2↑ |
取0.2mol?L-1HX溶液与0.2mol?L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是( )
| A、混合溶液中由水电离出的c(OH?)<0.2mol?L-1HX溶液中由水电离出的c(H+) |
| B、c(Na+)=c(X?)+c(HX)=0.2mol?L-1 |
| C、c(Na+)-c(X?)=9.9×10-7mol?L-1 |
| D、c(OH?)+c(HX)=c(H+)=1×10-8mol?L-1 |
我们食用的大豆,最终补充给人体的主要成分是( )
| A、氨基酸 | B、蛋白质 |
| C、多肽 | D、糖类 |
元素及其化合物丰富了物质世界,下列说法正确的是( )
| A、常温下铁在冷的浓硫酸中会钝化,所以常温下铁与浓硫酸不反应 |
| B、稀Na2CO3溶液和稀H2SO4溶液相互滴加的现象相同,而氨水与FeCl3溶液相互滴加现象不同 |
| C、金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| D、工业上常用石灰乳和氯气来制备漂白粉,漂白粉的有效成份是Ca(ClO)2 |
下列有关实验操作的叙述不正确的是( )
| A、用干燥、洁净的玻璃棒醮取待测液滴在 pH试纸(置于表面皿内)上测溶液的pH |
| B、烧瓶、锥形瓶、烧杯加热时都要垫石棉网 |
| C、制备Fe(OH)3胶体时,应往沸水中加饱和FeC13溶液,并继续加热至溶液呈现红褐色为止 |
| D、已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |