题目内容
19.将10.000g氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼烧后残留物的质量为9.813g,若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀干燥后质量为0.721g.求原混合物的质量.分析 根据通入足量Cl2充分反应,然后把溶液蒸干并灼烧,发生反应为2KBr+Cl2═2KCl+Br2,固体质量变化为KBr生成KCl的变化,利用差量法计算NaBr的质量,根据将此残留物再溶于水加入足量的碳酸钠溶液,所得的沉淀为碳酸钙,根据氯化钙与碳酸钠反应方程式计算氯化钙的质量,根据总质量减去溴化钠和氯化钙的质量即得氯化钠的质量.
解答 解:设混和物中NaCl质量为x,KBr质量为y,CaCl2质量为z.
则x+y+z=10.000g
通入足量Cl2充分反应,然后把溶液蒸干并灼烧,发生反应为2KBr+Cl2═2KCl+Br2,固体质量变化为KBr生成KCl的变化,利用差量法计算,
2KBr+Cl2═2KCl+Br2 固体质量减少
2×119 2×74.5 (119g-74.5g)×2=89g
y (10.000g-9.813g)=0.187g
y=$\frac{0.187g×119×2}{89}$≈0.500g,
将此残留物再溶于水加入足量的碳酸钠溶液,所得的沉淀为碳酸钙,
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
z 0.721g
z=$\frac{111×0.721g}{100}$=0.800g,
混合物中氯化钠的质量为:10.000g-0.500g-0.800g=8.700g,
答:混合物中含有8.700g氯化钠、0.500g溴化钾和0.800g氯化钙.
点评 本题考查混合物反应的计算,题目难度中等,注意掌握差量法在化学计算中的应用方法,明确发生反应原理为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
10.美国等国家发射的航天器将华裔科学家丁肇中负责研制的磁谱仪带人太空,其目的是探索反物质.反物质的主要特征是电子带正电荷,质子带负电荷.以下表示反物质酸碱中和反应的通式是( )
| A. | H-+OH+=H2O | B. | H++OH+=H2O | C. | H-+OH-=H2O | D. | H++OH-=H2O |
4.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法不正确的( )
| A. | X与Y形成的化合物是离子化合物,且最外层电子均满足8电子结构的 | |
| B. | 工业上通常采用电解Y的熔融氧化物的方法制得Y | |
| C. | 其离子半径大小:Z>Y>X | |
| D. | X和Z的最高价氧化物对应的水化物都是强酸 |
11.如表所示的五种元素中,甲、乙、丙、丁为短周期元素,其中乙是地壳中含量最多的元素.下列说法正确的是
( )
( )
| 甲 | 乙 | ||
| 丙 | 丁 | ||
| 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 丁和戊的原子核外电子数相差8 | |
| C. | 最高价氧化物对应的水化物的酸性:丙>丁 | |
| D. | 甲的单质在空气中燃烧生成只含共价键的化合物 |
 ②
②
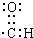 ③
③
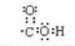 ④-C≡C-
④-C≡C- .
.