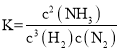题目内容
【题目】关于化学反应的方向,下列说法错误的是( )
A.在温度、压强一定的条件下,焓与熵因素共同决定一个化学反应的方向
B.温度、压强一定时,放热的熵增加反应 一定能自发进行
C.反应![]() △H < 0,低温有利于反应自发进行
△H < 0,低温有利于反应自发进行
D.固体溶解过程与焓变有关
【答案】D
【解析】
在一定的条件下,一个化学反应能否自发进行,既可能与反应的焓变有关,又可能与反应的熵变有关.在温度、压力一定的条件下,化学反应的方向是熵变和焓变共同影响的结果;温度、压强一定时,反应方向的判据是△G=△H-T△S,△G>0反应不能自发进行,△G<0反应能自发进行,△G=0达到平衡。
A、在温度、压强一定的条件下,化学反应的方向是熵变和焓变共同影响的结果,故A不符合题意;
B、放热反应△H<0,熵增加的反应,△S>0,△HT△S一定小于0,反应一定能自发进行,故B不符合题意;
C、反应![]() △H < 0,该反应为熵减反应,△S<0,若使△HT△S小于0,则需满足T较低,即低温有利于反应自发进行,故C不符合题意;
△H < 0,该反应为熵减反应,△S<0,若使△HT△S小于0,则需满足T较低,即低温有利于反应自发进行,故C不符合题意;
D、固体的溶解过程是熵值增加的过程,与焓变无关,故D符合题意。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
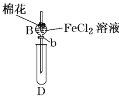
(1)棉花中浸润的溶液为____________,目的是____________________
(2)过程Ⅲ中一定发生反应的离子方程式为________________________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是______________________________________。
(3)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是___________________________。
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |