题目内容
1.C、Si、S和N元素在化学中占有极其重要的地位.(1)写出Si的基态原子价电子排布式3s23p2.
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为O>C>Si.
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为sp3,微粒间存在的作用力是共价键.
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似.MO的熔点比CaO的高,其原因是Mg2+半径比Ca2+小,MgO晶格能大.
(4)SO2、NO2、H2S同属于V字型结构(填“三角锥形”、“直线型”或“V字型”).从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是H2S.
分析 (1)Si元素14号元素,其3s、3p电子为其价电子,根据构造原理书写其价电子排布式;同一周期元素,元素的非金属活泼性随着原子序数的增大而增强,同一主族,元素的非金属活泼性随着原子序数的增大而减弱;
(2)晶体硅中一个硅原子周围与4个硅原子相连,呈正四面体结构,所以杂化方式是sp3;非金属原子之间形成的化学键为共价键;
(3)氧化镁与氧化钙都属于离子晶体,离子所带电荷相同,离子半径越小,离子键越强,晶格能越大,熔沸点越高;
(4)H2S的分子结构为V字型;H2S有2对孤电子,和其他两种不一样.
解答 解:(1)Si元素14号元素,其3s、3p电子为其价电子,根据构造原理知其价电子排布式为3s23p2;同一周期元素,元素的非金属活泼性随着原子序数的增大而增强,同一主族,元素的非金属活泼性随着原子序数的增大而减弱,根据元素在周期表中的位置知,这三种元素的非金属活泼性强弱顺序是:O>C>Si;
故答案为:3s23p2;O>C>Si;
(2)SiC中Si和C原子均形成四个单键,故其为sp3杂化;非金属原子之间形成的化学键全部是共价键;
故答案为:sp3;共价键;
(3)氧化镁与氧化钙都属于离子晶体,离子所带电荷相同,Mg2+离子比Ca2+离子半径小,MgO中离子键强,MgO比CaO的晶格能大,故MgO熔沸点高;
故答案为:Mg2+半径比Ca2+小,MgO晶格能大;
(4)SO2、NO2、H2S是分子晶体,分子结构为V字型,但H2S有2对孤电子,和其他两种不一样.
故答案为:V字型;H2S.
点评 本题主要考查物质结构和性质,涉及电子排布式的书写、非金属的大小比较、杂化轨道类型的判断以及晶体熔点的比较,题目较为综合,本题易错点为(4)题,注意形成π键的因素.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
1.由两种金属组成的合金8g,投入到足量的稀硫酸中,测得产生气体5.6L(标准状况),则原合金不可能是( )
| A. | Mg-Cu合金 | B. | Mg-Fe合金 | C. | Al-Zn合金 | D. | Fe-Zn合金 |
12.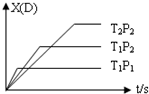 已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
 已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )| A. | 正反应为放热反应 | B. | m+n>p+q | ||
| C. | T1<T2 | D. | P1<P2 |
9.下列各组中的化学性质比较,不正确的是( )
①酸性:HClO4>HBrO4>HIO4
②还原性:I-<Cl-<F-
③碱性:NaOH>Mg(OH)2>Al(OH)3
④稳定性:PH3>H2S>HCl
⑤半径:S2->Na+>Mg2+>O2-
⑥氧化性:Li+>Na+>K+>Rb+>Cs+.
①酸性:HClO4>HBrO4>HIO4
②还原性:I-<Cl-<F-
③碱性:NaOH>Mg(OH)2>Al(OH)3
④稳定性:PH3>H2S>HCl
⑤半径:S2->Na+>Mg2+>O2-
⑥氧化性:Li+>Na+>K+>Rb+>Cs+.
| A. | ①②④ | B. | ②④⑤ | C. | ①⑤⑥ | D. | ②③⑤ |
16.根据陈述的知识,类推得出的结论正确的是( )
| A. | 镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O | |
| B. | 乙烯(CH2=CH2)可使酸性高锰酸钾溶液褪色,则丙烯(CH3-CH=CH2)也可以使其褪色 | |
| C. | CO2和SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | 金刚石的硬度大,则C60的硬度也大 |
6.下列关于胶体的叙述中不正确的是( )
| A. | 丁达尔现象可用来区别胶体与溶液 | |
| B. | 溶液、胶体、浊液的根本区别是分散质粒子直径的大小 | |
| C. | 胶体在一定条件下会发生聚沉 | |
| D. | 胶体粒子能通过半透膜,不能通过滤纸 |
10.在标准状况下,进行甲、乙、丙三组镁铝合金与盐酸反应实验,三组实验的有关数据如表:
试完成下列问题:
(1)①甲组实验中,盐酸过量(填“过量”“适量”或“不足量”),理由是HCl的物质的量一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积
②乙组实验中,盐酸不足(填“过量”“适量”或“不足量”),理由是生成336mL氢气需要合金的质量为255mg×$\frac{336mL}{280mL}$=306mg<385mg
(2)求合金中镁、铝的物质的量之比,题中可作计算依据的数据是甲,求得镁、铝的物质的量之比是1:1;
(3)求HCl的物质的量.
| 组别 | 镁铝合金质量.mg | HCl物质的量/mol | 氢气的体积/mL |
| 甲 | 255 | X | 280 |
| 乙 | 385 | X | 336 |
| 丙 | 459 | X | 336 |
(1)①甲组实验中,盐酸过量(填“过量”“适量”或“不足量”),理由是HCl的物质的量一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积
②乙组实验中,盐酸不足(填“过量”“适量”或“不足量”),理由是生成336mL氢气需要合金的质量为255mg×$\frac{336mL}{280mL}$=306mg<385mg
(2)求合金中镁、铝的物质的量之比,题中可作计算依据的数据是甲,求得镁、铝的物质的量之比是1:1;
(3)求HCl的物质的量.