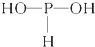题目内容
下列各组物质混合后能发生离子反应的是( )
| A、硫酸溶液与硝酸钾溶液混合 |
| B、氯酸钾与二氧化锰混合后加热 |
| C、铁与稀硫酸 |
| D、氢气与氧气混合后点燃 |
考点:离子反应的概念,离子反应发生的条件
专题:
分析:有离子参加的反应为离子反应,离子之间能反应生成气体、沉淀、弱电解质、络合物或发生氧化还原反应、双水解反应的就能发生离子反应,据此分析解答.
解答:
解:A.H2SO4和KNO3相互混合,没有生成气体、沉淀、弱电解质、络合物或发生氧化还原反应、双水解反应,所以没有离子反应发生,故A错误;
B.2KClO3
2KCl+3O2↑,该反应中有气体生成,但没有离子参加,所以不发生离子反应,故B错误;
C.该反应为Fe+2H+=Fe 2++H2↑,该反应中有离子参加,所以属于离子反应,故C正确;
D.2H2+O2
2H2O,该反应中有弱电解质生成但没有离子参加,所以不属于离子反应,故D错误;
故选C.
B.2KClO3
| ||
C.该反应为Fe+2H+=Fe 2++H2↑,该反应中有离子参加,所以属于离子反应,故C正确;
D.2H2+O2
| ||
故选C.
点评:本题考查离子反应,明确离子反应概念及离子反应条件是解本题关键,多少离子反应表示一类反应、化学反应表示一种反应,注意二者区别.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
下列关于2mol氧气的叙述中,正确的是( )
| A、质量是32g |
| B、体积是44.8L |
| C、分子数是2×6.02×1023 |
| D、电子数是32 |
下列图象中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是( )
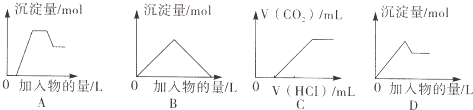

| A、图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀摄的关系曲线 |
| B、图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 |
| C、图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 |
| D、图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀最的关系曲线 |
 X、Y、Z、W均为常见的烃的含氧衍生物且物质类别不同,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W均为常见的烃的含氧衍生物且物质类别不同,它们之间存在如图所示的转化关系.下列判断正确的是( )| A、X是羧酸,Y是酯 |
| B、Z是醛,W是羧酸 |
| C、Y是醛,W是醇 |
| D、X是醇,Z是酯 |
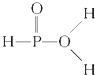
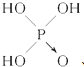 )中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )
)中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )