��Ŀ����
����̼ѭ������������ĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӡ����ԡ���̼���á�����Ϊ��ѧ���о�����Ҫ���⡣
��1���õ绡���ϳɵĴ�������̼�ܳ����д�����̼�����������ʣ������ֿ������������������ᴿ������ɸ÷�Ӧ�Ļ�ѧ����ʽ�����ڷ���������ϵ����
��C+��KMnO4+��H2SO4 =��CO2��+��MnSO4 +��K2SO4+��
��2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO��g����H2O��g�� CO2��g����H2��g�����õ����¶������ݣ�
CO2��g����H2��g�����õ����¶������ݣ�
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1��6 | 2��4 | 6 |
| 2 | 900 | 2 | 1 | 0��4 | 1��6 | 3 |
��ʵ��1�����£���Ӧ�ӿ�ʼ���ﵽƽ�⣬��v(CO2)��ʾ��ƽ����Ӧ����Ϊ ������С������λ������ͬ����
��ʵ��2������ƽ�ⳣ��K=____ _____���÷�ӦΪ ������ȡ����ȡ�����Ӧ��
��3����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) +3O2(g)��2CO2(g)+4H2O(g) ��H1����1275.6 kJ��mol
�� 2CO (g)+ O2(g)��2CO2(g) ��H2����566.0 kJ��mol
�� H2O(g)��H2O(l) ��H3����44.0 kJ��mol
д���״�����ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ����ʽ�� ��
��4��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�á�
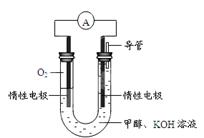
�ٸõ�������ĵ缫��ӦʽΪ�� ��
�ڸõ�ع���ʱ����Һ�е�OH����______����������������ƶ���
��16�֣�
��1��5 C+4KMnO4 +6 H2SO4=5CO2��+4MnSO4+2K2SO4+6H2O��3�֣�����1�֣���ƽ2�֣�
��2����0.13mol/(L��min) (2��) ��0.17��2�֣��� ���ȣ�2�֣�
��3��2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g) ��H=��709.6kJ/mol��CH3OH��l��+O2��g��= CO��g��+2H2O��g����H=��354.8kJ/mol��3�֣�
��4����O2 + 4e��+ 2 H2O = 4OH����2�֣��������ڸ���2�֣�
���������������1���۲컯ѧ����ʽ�����ұ��Ԫ�أ��ٸ��ݻ��ϼ۱仯������С�������������������ͻ�ԭ����ϵ��������ù۲취��ƽ�����ʵ�ϵ����̼Ԫ����0����Ϊ+4�ۣ���Ԫ����+7�۽�Ϊ+2�ۣ������������ֱ�Ϊ4��5������С������Ϊ20�����Ը÷�ӦΪ5C+4KMnO4 +6H2SO4=5CO2��+4MnSO4+2K2SO4+6H2O����2���ٶ�������Ϣ�����ɶ���ʽ��v(CO)������ϵ������v(CO2)����v(CO)=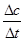 =
=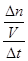 =
=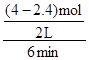 = 0.13mol/(L��min)��������λ��Ч���֣�������
= 0.13mol/(L��min)��������λ��Ч���֣������� =
= ����v(CO2)=v(CO)=0.13mol/(L��min)���ڱ���ʵ��2�й���ֵ���ʼ���ʵ�����ƽ�����ʵ�����֪���������Ϊ2L������c=n/V����
����v(CO2)=v(CO)=0.13mol/(L��min)���ڱ���ʵ��2�й���ֵ���ʼ���ʵ�����ƽ�����ʵ�����֪���������Ϊ2L������c=n/V����
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
��ʼŨ�ȣ�mol/L�� 1 0.5 0 0
�仯Ũ�ȣ�mol/L�� 0.2 0.2 0.2 0.2
ƽ��Ũ�ȣ�mol/L�� 0.8 0.3 0.2 0.2
K=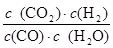 =
=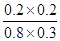 =0.17
=0.17
���ñ���ʵ��1�й���ֵ���ʼ���ʵ�����ƽ�����ʵ�����֪���������Ϊ2L������c=n/V����
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
��ʼŨ�ȣ�mol/L�� 2 1 0 0
�仯Ũ�ȣ�mol/L�� 0.8 0.8 0.8 0.8
ƽ��Ũ�ȣ�mol/L�� 1.2 0.2 0.8 0.8
K`=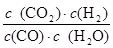 =
=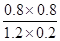 =2.67
=2.67
650���900�棬�����¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���ƽ�ⳣ����2.67����Ϊ0.17��˵��ƽ�����淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ��
��3���۲�3���Ȼ�ѧ����ʽ�����֢١��ڿ���Լȥ2CO2(g)�����ݸ�˹���ɣ���2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g) ��H=��709.6kJ/mol����ϵ�����룬��CH3OH(l)+O2(g)=CO(g)+2H2O(g) ��H=��354.8kJ/mol����4���ټ���ȼ�ϵ�ص�������Ӧ��������������KOH��Һ�Լ��ԣ����ݵ��ӡ���ɡ�ԭ���غ�ԭ������������ӦʽΪO2+4e��+ H2O=4OH�����ڵ��Ӵ����磬�缫���ϱ��������磬�����������Ӵ����磬�����Һ�д����������������������������������Ӵ����磬�����Һ�д����������������������
���㣺���黯ѧ��Ӧԭ�����漰������ԭ��Ӧ��Ӧ����ʽ����ƽ��ƽ����Ӧ���ʵļ��㡢��ѧƽ�ⳣ���ļ�����Ƚϡ��¶ȶ�ƽ���ƶ���Ӱ����ɵ�Ӧ�á����ȷ�Ӧ�����ȷ�Ӧ����˹���ɡ�ȼ�ϵ�ص�������Ӧʽ�����Ӷ����ƶ����ɵ�Ӧ�õȡ�

 һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�[15��]���������������Ƚ������ⷽ������������������������������Ӧϵͳͬʱͨ����顢������ˮ��������������Ҫ��ѧ��Ӧ�У�
| ��Ӧ���� | ��ѧ����ʽ | �ʱ��H (kJ/mol) | ���Ea (kJ/mol) |
| �������� | CH4(g)��2O2(g) CO2(g)��2H2O(g) CO2(g)��2H2O(g) | ��802.6 | 125.6 |
CH4(g)��O2(g) CO2(g)��2H2(g) CO2(g)��2H2(g) | ��322.0 | 172.5 | |
| �������� | CH4(g)��H2O(g) CO(g)��3H2(g) CO(g)��3H2(g) | 206.2 | 240.1 |
CH4(g)��2H2O(g) CO2(g)��4H2(g) CO2(g)��4H2(g) | 165.0 | 243.9 |
��1����ӦCO(g)��H2O(g)
 CO2(g)��H2(g)�ġ�H= kJ/mol��
CO2(g)��H2(g)�ġ�H= kJ/mol����2���ڳ�ʼ��,�������������ķ�Ӧ���� ���������ķ�Ӧ���ʣ�����ڡ�С�ڻ���ڣ���
��3���������෴Ӧ����ij���(B)��ƽ��ѹǿ(PB)�������ʵ���Ũ��(cB)Ҳ����ƽ�ⳣ��������KP������ӦCH4(g)��H2O(g)
 CO(g)��3H2(g)��KP�� ��
CO(g)��3H2(g)��KP�� �������¶ȵ����ߣ���ƽ�ⳣ�� �����������С�����䡱����
��4���������η������������������������Ƚ�֮������ ��
��5����ijһ�������ϱȵ�����£��¶ȡ�ѹǿ��H2��CO���ʵ���������Ӱ������ͼ��
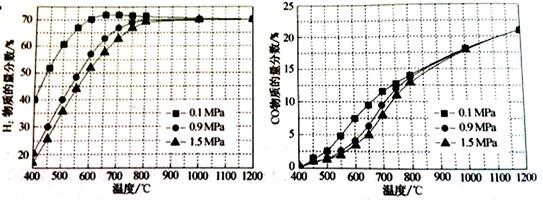
����Ҫ�ﵽH2���ʵ�������>65%��CO�����ʵ�������<10%����������������ʵ��� ��
A��600�棬0.9Mpa B��700�棬0.9MPa C��800�棬1.5Mpa D��1000�棬1.5MPa
�ڻ���600�棬0.1Mpa�����£�ϵͳ��H2���ʵ��������淴Ӧʱ�䣨�ӳ��½��Ͽ�ʼ��ʱ��
�ı仯����ʾ��ͼ��
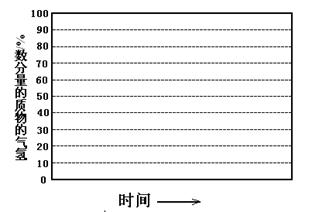
��6������������������������յ���H2���ʵ����������ͣ�ԭ���� ��
��1������ͬ����CO��g����H2O��g���ֱ�ͨ�����2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g�� CO2��g��+H2��g�����õ������������ݣ�
CO2��g��+H2��g�����õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
��ʵ��1����v(CO2)��ʾ��ƽ����Ӧ����Ϊ ���ڶ�λС������
�ڸ÷�ӦΪ ������ȡ����ȡ�����Ӧ��
����ʵ��2��ƽ������K��Ҫ��д��������̣����ȡ��λС����
��2����֪�ڳ��³�ѹ�£�

д���״�����ȫȼ������CO��Һ̬ˮ���Ȼ�ѧ����ʽ ��
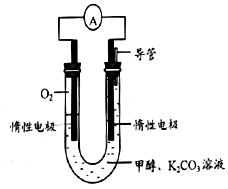
��3���״���������ȫȼ�յķ�Ӧ�������Ϊȼ�ϵ�أ�װ����ͼ���õ��ͨ��K2CO3��Һ���շ�Ӧ����CO2�����ĵ缫��ӦΪ ��
��4��CaCO3��KSP=2.8��10¯9���������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10¯4mol/L�������ɳ��������CaCl2��Һ����СŨ��Ϊ ��
��֪����KI�����ᡢ�Լ�X�͵���������Һ��ϣ���Ӧ���������ټ���˫��ˮ����������Ӧ��H2O2+2H++2I����2H2O+I2�������ɵ�I2�������Լ�X��Ӧ�������ġ�һ��ʱ����Լ�X������Ӧ���ɵ�I2��ȫ���ġ�������Һ�е�I��������H2O2���������ɵ�I2��������ã���Һ������������ˣ������Լ�X����������˫��ˮ����Һ���������ʱ�䣬�������㷴ӦH2O2+2H++2I����2H2O+I2�ķ�Ӧ���ʡ�
�±�Ϊijͬѧ��������ԭ����Ƶ�ʵ�鼰ʵ���¼����ʵ��������������½��У���
| ��� | ���ձ��м�����Լ�����������mL�� | ���� | ��ʼ����ʱ�䣨min�� | ||||
| 0.1 mol��L��1 KI��Һ | H2O | 0.01 mol��L��1 X��Һ | 0.1 mol��L��1 ˫��ˮ | 1 mol��L��1 ϡ���� | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | �� | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | �� | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | �� | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5��Fe2(SO4)3 | 0.6 |
��1����֪��ʵ��1��2��Ŀ����̽��H2O2Ũ�ȶ�H2O2+2H++2I����2H2O+I2��Ӧ���ʵ�Ӱ�졣ʵ��2��m= ��n= ��
��2����֪��I2��X��Ӧʱ���������ʵ���֮��Ϊ1��2����������е�X��KI�ļ�����������V��H2O2��>________����ȷ��������ɫ��
��3��ʵ��1��Ũ��c(X)~ t�ı仯������ͼ�������������������䣬���ڴ������ͼ�У��ֱ�ʵ��3��ʵ��4��c(X)~ t�ı仯����ͼ��������Ӧ�ı�ע����
��4��ʵ��3����������������߷�Ӧ���ʡ������ܼӿ췴Ӧ��������Ϊ���� (���ߡ����͡�)�˷�Ӧ��ܡ�
��5�������Ѻ����������������Ƴɹ�����֪����ܷ�ӦΪ��2Al��s��+3I2��s��
 2AlI3��s������I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��______________________________�����ʱAl���ӵ�Դ��___________����
2AlI3��s������I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��______________________________�����ʱAl���ӵ�Դ��___________���� ���Ʊ��������о���ѧ�仯���ɵ���Ҫ˼�뷽��������ϸ�۲��±���50mlϡ�����1g̼��Ʒ�Ӧ��ʵ�����ݣ�
| ʵ�� ��� | ̼���״̬ | c(HCl)/mol��L-1 | ��Һ�¶�/oC | ̼�����ʧʱ��/s | |
| ��Ӧǰ | ��Ӧ�� | ||||
| 1 | ��״ | 0��5 | 20 | 39 | 400 |
| 2 | ��ĩ | 0��5 | 20 | 40 | 60 |
| 3 | ��״ | 0��6 | 20 | 41 | 280 |
| 4 | ��״ | 0��8 | 20 | 40 | 200 |
| 5 | ��ĩ | 0��8 | 20 | 40 | 30 |
| 6 | ��״ | 1��0 | 20 | 40 | 120 |
| 7 | ��״ | 1��0 | 30 | 50 | 40 |
| 8 | ��״ | 1��2 | 20 | 40 | 90 |
| 9 | ��״ | 1��2 | 25 | 45 | 40 |
��1������Ӧ����__________��Ӧ(����ȡ����ȡ�)����Ӧ�����ӷ���ʽ_____________��
��2��ʵ��6��7������___________�Է�Ӧ������Ӱ�죬__________��Ӧ����Խ�죬�ܱ���ͬһ���ɵ�ʵ�黹��_____________(��ʵ�����)��
��3������ʵ��1��3��4��6��8���Եó������Է�Ӧ���ʵ�Ӱ�������_____________________��
��4����ʵ����Ӱ�췴Ӧ���ʵ��������ػ���________________���ܱ�����һ���ɵ�ʵ�������1��2��____________��
���ᣨH2C2O4����Һ������KMnO4��Һ��Ӧʱ����Һ��ɫ����������졣ijѧϰС���ϻ�ѧ��Ӧԭ�������������裬�������һϵ��ʵ�����̽����
ʵ�����2֧�Թ��зֱ����5 mL��Ũ�ȵ�H2C2O4��Һ��������һ֧�Թ����ȼ�������MnSO4�����ٸ�����5��0.1 mol��L-1 KMnO4��Һ����¼��Һ��ɫʱ�䣬���1��
| �� �� | δ��MnSO4���Թ� | ����MnSO4���Թ� |
| ��ɫʱ�� | 30 s | 2 s |
ʵ�����ȡ2֧�Թֱܷ����5 mL��Ũ�ȵ�H2C2O4��Һ��������һ֧�Թ����ȼ���10��ϡ���ᣬ�ٸ�����5��0.1 mol��L-1 KMnO4��Һ����¼��Һ��ɫʱ�䣬���2��
| �� �� | δ�μ�ϡ������Թ� | �μ���ϡ������Թ� |
| ��ɫʱ�� | 100 s | 90 s |
ʵ�����ȡ3֧�Թֱܷ����5 mL��Ũ��H2C2O4��Һ��Ȼ�����Թ����ȷֱ����10�Ρ�1 mL��2 mLϡ������Һ���ٸ�����5��0.1 mol��L-1 KMnO4��Һ��Ȼ�������¶�Ϊ65���ˮԡ�м��ȡ���¼��Һ��ɫʱ�䣬���3��
| �� �� | ����10��ϡ������Թ� | ����1 mLϡ������Թ� | ����2 mLϡ������Թ� |
| ��ɫʱ�� | 70 s | 100 s | 120 s |
��1��ʵ���ó��Ľ�����_____��
��2���Ƚ�ʵ���ó��Ľ�����ȷ���ǣ�_____��[��
���¶ȶԸ÷�Ӧ������Ӱ��
������Բ����KMnO4��Һ�ķ�Ӧ��Ӱ��
�ۼ����������ᣬ�ɴٽ������KMnO4��Һ��Ӧ��������������ᣬ��Ӧ���ʱȽ�С
�������Է�Χ�ڣ�pHֵԽС�Է�ӦԽ����[
��3��д��������Һ������KMnO4��Һ��Ӧ�����ӷ���ʽ��____��ʵ�������ø÷�Ӧ�궨δ֪Ũ��H2C2O4��Һ���ζ��յ�������ǣ���Һ��ɫ_____����30 s���ı䡣�ζ���ɺ����Ӷ�ȡKMnO4��Һ����ᵼ�²��H2C2O4��Һ��Ũ��____��ѡ�ƫ��ƫС����Ӱ�죩��
��4����ͬѧ���ݲ��ĵ��������KMnO4��Һ����H2C2O4�ķ�Ӧ����Ϊ��

����ʵ���У�ʵ��_____��֤����������ǿ��ŵġ�
�����£�Na2CO3��Һ�д���ƽ�⣺CO32��+H2O HCO3��+OH���������йظ���Һ��˵����ȷ����
HCO3��+OH���������йظ���Һ��˵����ȷ����
| A������Ũ�ȣ�c(Na+)>c(CO32��)>c(OH��)>c(H+) | B�������¶ȣ�ƽ�������ƶ� |
| C������CaCl2Ũ��Һ����Һ��pH���� | D������NaOH���壬��Һ��pH��С |

 2NH3(g) ��H=��94.4kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ��
2NH3(g) ��H=��94.4kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ��
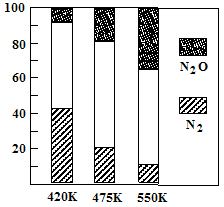
 5N2O(g)+3H2O(g) ��H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ����ͼ����ش���400K��600Kʱ��ƽ��������N2�������¶ȵı仯������ ���������ֹ��ɵ�ԭ���� ���δ������һ��ԭ��
5N2O(g)+3H2O(g) ��H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ����ͼ����ش���400K��600Kʱ��ƽ��������N2�������¶ȵı仯������ ���������ֹ��ɵ�ԭ���� ���δ������һ��ԭ��