题目内容
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 0.2molH2O和D2O形成的混合物中,含有中子的数目为2NA | |
| B. | 含有0.1molNH4+的氨水中,含有OH-的数目为0.1NA | |
| C. | 400mL1mol•L-1稀硝酸与Fe完全反应(还原产物只有NO),转移电子的数目为0.3NA | |
| D. | 30g乙酸和乙酸乙酯的混合物完全燃烧,消耗O2的分子数目为NA |
分析 A、普通水中含8个中子,而重水中含10个中子;
B、在氨水溶液中,存在电荷守恒:n(NH4+)+n(H+)=n(OH-);
C、400mL 1mol/L稀硝酸与Fe完全反应生成产物为硝酸铁或硝酸亚铁,结合电子守恒计算;
D、30g乙酸耗氧量=$\frac{30g}{60g/mol}$×(2+$\frac{4}{4}$-$\frac{2}{2}$)=2mol,30g乙酸乙酯耗氧量=$\frac{30g}{88g/mol}$×(4+$\frac{8}{4}$-$\frac{2}{2}$)=$\frac{150}{88}$mol.
解答 解:A、普通水中含8个中子,而重水中含10个中子,故0.2molH2O和D2O形成的混合物中,中子数小于2NA个,故A错误;
B、在氨水溶液中,存在电荷守恒:n(NH4+)+n(H+)=n(OH-),而由于含有n(NH4+)=0.1mol,故n(OH-)>0.1mol,即氢氧根大于0.1NA个,故B错误;
C、.400mL 1mol/L稀硝酸物质的量=0.4L×1mol/L=0.4mol,生成硝酸亚铁3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,生成硝酸铁,Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,每反应4molHNO3电子转移3mol,0.4mol稀硝酸与Fe完全反应(还原产物只有NO),转移电子的数目为0.3NA ,故C正确;
D、30g乙酸耗氧量=$\frac{30g}{60g/mol}$×(2+$\frac{4}{4}$-$\frac{2}{2}$)=2mol,30g乙酸乙酯耗氧量=$\frac{30g}{88g/mol}$×(4+$\frac{8}{4}$-$\frac{2}{2}$)=$\frac{150}{88}$mol..30 g乙酸和乙酸乙酯的混合物完全燃烧,消耗O2的分子数目为2NA-$\frac{150}{88}$NA间,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

| A. |  吸收NH3 | B. |  检验K2CO3中的K+ | ||
| C. |  证明氨气极易溶于水 | D. |  实验室制氨气 |
| A. | 充电时电池反应式为FePO4+Li═LiFePO4 | |
| B. | 放电时在正极上是Li+得电子被还原 | |
| C. | 放电时电池内部Li+向正极移动 | |
| D. | 充电时动力电池上“+”的电极与外接电源的负极相连 |
 短周期元素X、Y、Z.W的原子序数依次增大.在如图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物.常温时,0.1mol•L-1的a溶液的pH为1,d为红棕色气体,e为无色气体.下列说法正确的是( )
短周期元素X、Y、Z.W的原子序数依次增大.在如图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物.常温时,0.1mol•L-1的a溶液的pH为1,d为红棕色气体,e为无色气体.下列说法正确的是( )| A. | 元素的非金属性:Y>Z>X | |
| B. | 反应①中消耗lmola时转移电子数与反应②中生成1mol a时转移电子数相等 | |
| C. | 原子半径的大小:y<Z<W | |
| D. | Y的氢化物常温常压下为气态 |
| A. | 四氯化碳分子比例模型: | B. | 二 氧化硅的分子式:SiO2 | ||
| C. | 溴化铵的电子式: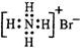 | D. | S2-离子结构示意图: |
| A. | 钌催化剂能加快该反应的速率 | B. | 升高温度能减慢该反应的速率 | ||
| C. | 达到平衡时,CO2能100%转化为CH4 | D. | 达到平衡时,反应速率:v(正)=v(逆)≠0 |
| A. | 钠具有良好的导电性,密度比水的小 | |
| B. | 钠在空气中最后变为白色的碳酸钠 | |
| C. | Ca(OH)2饱和溶液中加入Na的小颗粒,会析出固体 | |
| D. | 钠在工业上用于制造氯化钠、氢氧化钠、碳酸钠等化合物 |