题目内容
10.有A、B、C、D、E、F六种微粒,它们都含有10个电子,已知 A+B=2C; A+D=E+C;2A+F=G↓; G中含有30个电子.试推断后回答:(1)A、B、E的电子式:A
 B
B E
E
(2)C、D、的化学符号:CH2ODNH4+.
分析 常见10电子微粒有:一核:Ne、N3-、O2-、F-、Na+、Mg2+、Al3+;
二核:HF、OH-;
三核:H2O、NH2-;
四核:NH3、H3O+;
五核:CH4、NH4+;
已知 A+B=2C; A+D=E+C;2A+F=G↓; G中含有30个电子,结合常见10电子微粒分析.
解答 解:A+B=2C,C为水,H3O++OH-=2H2O,A+D=E+C;铵根离子与氢氧根离子发生反应生成水和氨气,即NH4++OH-=NH3↑+H2O,2A+F=G↓;G中含有30个电子,G为Mg(OH)2↓,Mg2++2OH-═Mg(OH)2↓;
则A为OH-,B为H3O+;C为H2O,D为NH4+,E为NH3,F为Mg2+,G为Mg(OH)2↓,
(1)A为OH-,氢氧根离子为阴离子,O原子周围8个电子,其电子式为 ;B为H3O+,电子式为:
;B为H3O+,电子式为: ,E为NH3,NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为
,E为NH3,NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,
,
故答案为: ;
; ;
; ;
;
(2)C为H2O,D为NH4+,故答案为:H2O;NH4+.
点评 本题考查了原子核外电子结构特征,物质转化关系的应用,主要是10电子微粒的分析和应用.熟练掌握常见10电子微粒是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1. 锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干.
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩.
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(l)在第②步中,将上述固体与浓盐酸混合的目的是将MnO2还原成Mn2+
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成.请写出加入NH4HCO3溶液时发生的离子反应方程式Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3;
假设二:全部为Mn(OH)2;
假设三:既有MnCO3又有Mn(OH)2
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成表中的内容.
②定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0g样品,加热,测得固体质量随温度的变化关系如图.根据图中的数据判断假设三成立,理由是300℃以后,质量增加量为MnO氧化为MnO2 ,计算可得MnCO3质量为11.5(或MnO(OH)2的质量为10.5g),所以既有MnCO3又有Mn(OH)2.
 锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干.
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩.
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(l)在第②步中,将上述固体与浓盐酸混合的目的是将MnO2还原成Mn2+
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成.请写出加入NH4HCO3溶液时发生的离子反应方程式Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3;
假设二:全部为Mn(OH)2;
假设三:既有MnCO3又有Mn(OH)2
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成表中的内容.
| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将所得沉淀过滤、洗涤, 将沉淀充分暴露于空气中,观察颜色 | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,加入足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
18.某元素的一种同位素X的原子质量数为A,含N个中子,它与2H原子组成2HmX分子,在ag 2HmX中所含质子的物质的量是( )
| A. | $\frac{a(A-N+m)}{A+m}$mol | B. | $\frac{a(A-N)}{A+m}$ mol | C. | $\frac{a(A-N+m)}{A+2m}$mol | D. | $\frac{a(A-N+m)/}{A}$mol |
5.某种兴奋剂的结构简式如图所示,有关该物质说法正确的是 ( )


| A. | 该分子中所有氢原子不可能在同一平面上 | |
| B. | 1mol该物质与氢气反应,最多消耗4mol氢气 | |
| C. | 加入FeCl3溶液呈紫色,因为该物质含有酚类结构特征 | |
| D. | 滴入酸性高锰酸钾溶液,紫色褪去,可证明结构存在碳碳双键 |
15.符合如图的反应是(T1T2是表示不同的温度)( )


| A. | X+3Y?2Z 正反应为吸热反应 | B. | X+3Y?2Z 正反应为放热反应 | ||
| C. | X+2Y?3Z 正反应为放热反应 | D. | 5Z+3Y?4Z 正反应为放热反应 |
2.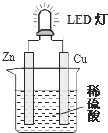 LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
 LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )| A. | 装置中存在“化学能→电能→光能”的转换 | |
| B. | 铜片上发生的反应为:2H++2e-=H2 | |
| C. | 如果将硫酸换成柠檬汁,导线中不会有电子流动 | |
| D. | 如果将锌片换成铁片,电路中的电流方向不变 |
