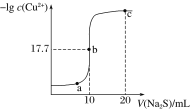
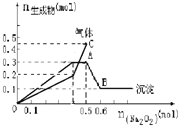
题目内容
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
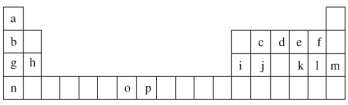
(1)写出24号元素Cr的基态原子的电子排布式____________。
(2)元素e的基态原子的电子排布图:_______________。
(3)c有_____种运动不同的电子
(4)比较g、h、i三种元素的第一电离能的大小顺序:_______________(按由大到小的顺序排列,用元素符号表示)。
(5)图中o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________。
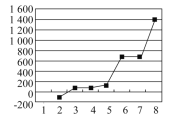
(6)第3周期主族元素按单质熔点高低的顺序如图所示,横坐标序号“8”代表______(填元素符号,下同)其中电负性最大的是____。
【答案】1s22s22p63s23p63d54s1或[Ar]3d54s1 ![]() 6 Mg>Al>Na Mn2+的3d轨道电子排布为半满状态,比较稳定,而Fe2+的3d轨道失去一个电子排布才为半满状态,比较稳定 Si Cl
6 Mg>Al>Na Mn2+的3d轨道电子排布为半满状态,比较稳定,而Fe2+的3d轨道失去一个电子排布才为半满状态,比较稳定 Si Cl
【解析】
根据元素周期表的结构可知a~p分别为H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe,再结合元素的结构以及性质进行分析答题。
(1)Cr为24号元素,其原子核外有24个电子,其基态原子的电子排布式为:1s22s22p63s23p63d54s1或[Ar]3d54s1,故答案为:1s22s22p63s23p63d54s1或[Ar]3d54s1。
(2)由元素周期表的结构可知:e为O元素,O为8号元素,其基态原子的电子排布式为:1s22s22p4,基态原子的电子排布图为:![]() ,故答案为:
,故答案为:![]() 。
。
(3)由元素周期表的结构可知:c为C元素,C为6号元素,其基态原子的电子排布式为:1s22s22p2,所以有6种运动不同的电子,故答案为:6。
(4)由元素周期表的结构可知:g为Na元素,h为Mg元素,i为Al元素,Na、Mg、Al是同一周期的元素,随着原子序数的增大,原子半径逐渐减小,元素失去电子逐渐减弱,所以元素的第一电离能逐渐增大,但是Mg原子的2s轨道上的电子处于全充满的稳定状态,失去电子比后面相邻的Al还难。故这三种元素中第一电离能最大的是Mg,所以三种元素的第一电离能的大小顺序:Mg>Al>Na,故答案为:Mg>Al>Na。
(5)根据元素周期表的结构可知:o为Mn元素,p为Fe元素,原子轨道处于半满、全满、全空时,能量更低、更稳定,Mn2+的价电子排布式为3d5,3d能级上有5个电子,为半充满状态,能量低更稳定,所以难再失去一个电子,而Fe2+的价电子排布式为3d6,3d能级上有个6电子,失去一个电子就达到3d5半充满稳定结构,故Fe2+容易再失去一个电子,故答案为:Mn2+的3d轨道电子排布为半满状态,比较稳定,而Fe2+的3d轨道失去一个电子排布才为半满状态,比较稳定。
(6)一般来说,熔点是:原子晶体>金属晶体>分子晶体,第3周期主族元素单质的熔点由高到低的顺序为Si>Al>Mg>Na>S>P>Cl2,根据图示可知,其中序号“8”代表Si,同周期从左到右,电负性逐渐增大(稀有气体除外),则第3周期电负性最大的是Cl,序号为2,故答案为:Si,2。