题目内容
设NA表示阿伏加德罗常数的数值,下 列说法正确的是
列说法正确的是
A.80 mL10 mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA
B.通入了1 mol Cl2的新制氯水中,HC1O、Cl-、C1O-粒子数之和为2NA
C.1 mol Na2O2中含有的阴离子数为2 NA
D.标准状况下,4.48L NH3中共用电子对数为0.6 NA
按要求完成下列空白:
⑴印刷电路板是由高分子材料和铜箔复合而成.刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请写出反应的离子方程式 。
⑵请写出在碱性溶液中,ClO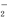 与Fe2+反应的离子方程式为: 。
与Fe2+反应的离子方程式为: 。
⑶NaAlH4是重要的还原剂。请写出NaAlH4与水发生氧化还原反应的化学方程式: 。
⑷+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,请写出该反应的离子方程式: 。
⑸亚氯酸钠(NaClO2)溶液可作为烟气的吸收剂,并对烟气进行脱硫、脱硝。在装有亚氯酸钠溶液的鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10?3mol·L?1。反应一段时间后溶液中离子浓度的分析结果如下表。
离 | SO | SO | NO | NO | Cl? |
c/(mol·L?1) | 8.35×10?4 | 6.87×10?6 | 1.5×10?4 | 1.2×10?5 | 3.4×10?3 |
写出NaClO2溶液脱硝过程中主要反应的离子方程式 。
25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20. 00mL浓度均为0.l000mol/L的两种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是
数据编号 | 滴入NaOH(aq) 的体积/mL | 溶液的pH | |
HX | HY | ||
① | 0 | 3 | 1 |
② | a | 7 | x |
③ | 20.00 | >7 | y |
A.在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B.由表中数据可估算出Ka(HX)≈10-5
C.HY和HX混合,c(H+)=c(X一)+c(Y一)+c(OH一)
D.上述②反应后的HY溶液中:c(Na+)>c(Y一)>c(OH一)>c(H+)
设NA阿伏伽德罗常数的值。己知反应
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H1=a kJ/mol
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H2=b kJ/mol,其它数据如表:
化学键 | C═O | O═O | C-H | O-H |
键能kJ·mol-1 | 798 | x | 413 | 463 |
下列说法正确的是
A.上表中 x=(1796+b)/2
B.H2O(g)═H2O(l) △S<0,△H═(a-b )kJ/mol
C.当有4NA个C-H键断裂时,该反应放出热量一定为a kJ
D.利用反应(1)设计的原电池电解精炼铜时,当负极输出0.2NA个电子时,电解槽的阳极质量一定减轻6.4g


 Fe3+,可能有Fe2+
Fe3+,可能有Fe2+ 粉末中一定有Na+,可能有K+
粉末中一定有Na+,可能有K+ 子
子


 .①②⑤⑥
.①②⑤⑥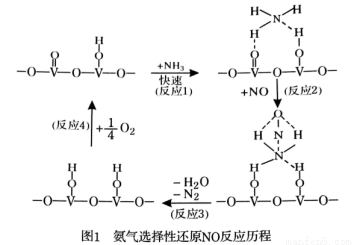
 2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。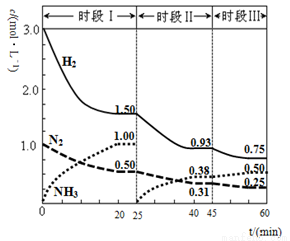
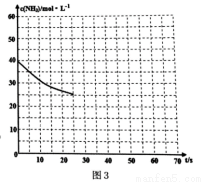
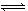 CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。