题目内容
17.分离提纯是化工生产中常用的方法.下列说法合理的是( )| A. | 蒸馏自来水可得到蒸馏水 | B. | 酸溶法除去Al2O3的Fe2O3 | ||
| C. | 过滤法除去乙酸中的乙醇 | D. | 碱溶法除去Al2O3中的SiO2 |
分析 A.自来水中水的沸点低;
B.二者均与酸反应;
C.乙酸、乙醇互溶;
D.二者均与碱反应.
解答 解:A.自来水中水的沸点低,则蒸馏自来水可得到蒸馏水,故A正确;
B.二者均与酸反应,不能除杂,故B错误;
C.乙酸、乙醇互溶,不能过滤分离,故C错误;
D.二者均与碱反应,则应选HF酸、过滤分离,故D错误;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握混合物分离提纯方法、物质的性质及差异为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列说法不合理的是( )
| A. | 用分液的方法分离植物油和水的混合物 | |
| B. | 乙烷中含有少量乙烯,提纯乙烷,用酸性高锰酸钾溶液洗气 | |
| C. | 用热的纯碱(Na2CO3)溶液洗涤餐具上的油污 | |
| D. | 粗铜精炼时,粗铜做电解池的阳极,纯铜做阴极 |
8.一种一元强酸HA溶液中加入一种碱MOH反应后,溶液呈中性,下列判断中正确的是( )
| A. | 若为强碱,则需加入的碱过量 | |
| B. | 混合前酸与碱中溶质的物质的量相等 | |
| C. | 生成的盐不发生水解 | |
| D. | 反应溶液中c(A-)、c(M+)相等 |
5.若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Al3+ Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- CO32- | D. | K+ NH4+ SO42- NO3- |
12.下列反应能说明苯酚分子中由于羟基对苯环的影响,使苯酚分子中苯环上的H原子比苯分子中苯环上的H原子活泼的是( )
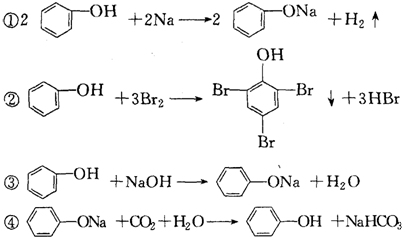

| A. | ①③ | B. | ②④ | C. | ② | D. | 都不可以 |
2.反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
| A. | v(A)=0.15 mol•L-1•min-1 | B. | v(B)=0.01 mol•L-1•s-1 | ||
| C. | v(C)=0.40 mol•L-1•min-1 | D. | v(D)=0.0075 mol•L-1•s-1 |
9.下列表述正确的是( )
| A. | c(OH-)/c(H+)═10-12的溶液中:NH4+、Cu2+、NO3-、Cl-能大量共存 | |
| B. | 通入过量SO2气体的溶液中:HSO3-、NO3-、Ba2+不能大量共存 | |
| C. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液的离子方程式为:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| D. | 向Fe(NO3)3溶液中加入HI溶液的离子方程式为:2Fe3++2I-═2Fe2++2I2 |
7.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是Ar(填具体元素符号,下同),原子结构示意图为 ;元素⑩名称为Br.
;元素⑩名称为Br.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: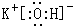 .
.
(3)元素⑤与⑦形成化合物的化学式为AlCl3;实验测得,当此化合物在液态或固态时不导电,溶解于水时能导电,由此判断该化合物属于共价化合物.
(4)元素③、⑥、⑦形成的气态氢化物中,沸点最高的物质的化学式是H2O,原因是H2O分子间含有氢键.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为Br.
;元素⑩名称为Br.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
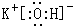 .
.(3)元素⑤与⑦形成化合物的化学式为AlCl3;实验测得,当此化合物在液态或固态时不导电,溶解于水时能导电,由此判断该化合物属于共价化合物.
(4)元素③、⑥、⑦形成的气态氢化物中,沸点最高的物质的化学式是H2O,原因是H2O分子间含有氢键.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
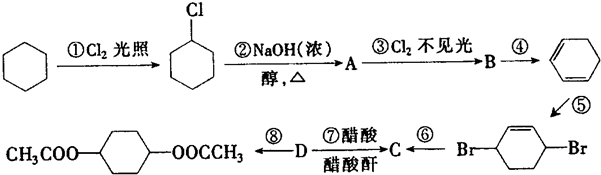
 ,C
,C .
.