题目内容
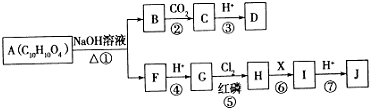
9.有机物A:(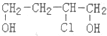 )是合成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂.
)是合成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂.(1)写出羟基(-OH)的电子式:
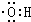 .
.(2)有机物A能够发生的反应有acd(填序号).
a.取代反应 b.加成反应 c.消去反应 d.酯化反应
(3)有机物A在Cu做催化剂和加热条件下,与氧气反应生成有机物B,B经氧化生成有机物C,C有如下图所示的转化关系:
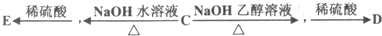
①写出E的结构简式HOOCCH2CH(OH)COOH.
②D在高温、高压和催化剂条件下生成HPMA,写出反应的化学方程式:
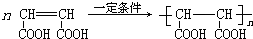 .
.
分析 (1)羟基中O原子含有1对共用电子对、2个孤对电子和1个孤电子;
(2)A中含有醇羟基和氯原子,具有醇、卤代烃的性质,能发生取代反应、氧化反应、消去反应、酯化反应等;
(3)有机物A在Cu做催化剂和加热条件下,A中醇羟基被氧气氧化生成醛基,B结构简式为OHCCH2CH(Cl)CHO;
有机物B经氧化后生成有机物C,C的结构简式为HOOCCH2CH(Cl)COOH,C和氢氧化钠的水溶液发生取代反应然后酸化生成E,E的结构简式为HOOCCH2CH(OH)COOH,C和氢氧化钠的醇溶液发生消去反应然后酸化生成D,D的结构简式为HOOCCH=CHCOOH;
①E为2-羟基1,4-丁二酸;
②D发生加聚反应生成高分子化合物HPMA.
解答 解:(1)羟基中O原子含有1对共用电子对、2个孤对电子和1个孤电子,其结构简式为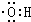 ,故答案为:
,故答案为: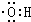 ;
;
(2)A中含有醇羟基和氯原子,具有醇、卤代烃的性质,能发生取代反应、氧化反应、消去反应、酯化反应等,因为不含不饱和键或苯环,所以不能发生加成反应,故选acd;
(3)有机物A在Cu做催化剂和加热条件下,A中醇羟基被氧气氧化生成醛基,B结构简式为OHCCH2CH(Cl)CHO;
有机物B经氧化后生成有机物C,C的结构简式为HOOCCH2CH(Cl)COOH,C和氢氧化钠的水溶液发生取代反应然后酸化生成E,E的结构简式为HOOCCH2CH(OH)COOH,C和氢氧化钠的醇溶液发生消去反应然后酸化生成D,D的结构简式为HOOCCH=CHCOOH;
①E为2-羟基1,4-丁二酸,其结构简式为HOOCCH2CH(OH)COOH,故答案为:HOOCCH2CH(OH)COOH;
②D发生加聚反应生成高分子化合物HPMA,反应方程式为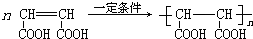 ,故答案为:
,故答案为: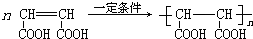 .
.
点评 本题考查有机物推断及有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,熟练掌握常见有机物官能团及其性质,注意醇或卤代烃发生消去反应时有机物特点,题目难度不大.


根据实验所得数据,有关说法正确的是( )
| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
 关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )| A. | 乙醇可以用来制饮料 | |
| B. | 1 mol乙醇完全燃烧时生成3mol水 | |
| C. | 1mol乙醇与足量的钠作用生成1g H2 | |
| D. | 物质的量相同的乙醇和乙烯气体完全燃烧,耗氧量相同 |
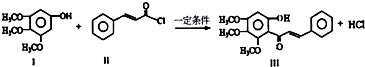
| A. | Ⅰ在空气中不能稳定存在 | |
| B. | 可用FeCl3溶液鉴别有机物Ⅱ和Ⅲ | |
| C. | Ⅱ中所有原子一定不可能共面 | |
| D. | 1mol产物Ⅲ与足量溴水反应,消耗Br2 的物质的量为1.5mol |
| A. | 用稀氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| C. | 用酸性KMnO4溶液鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO | |
| D. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
| A. | 氯化镁 | B. | 过氧化钠 | C. | 单质碘 | D. | 水 |
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
| 温度/K | 反应Ⅰ | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g)反应发生,所以能提高CH3OCH3的产率,原因是反应消耗了H2O(g)有利于反应Ⅱ、Ⅲ正向移动;同时此反应生成了H2,有利于反应I、Ⅲ正向移动.
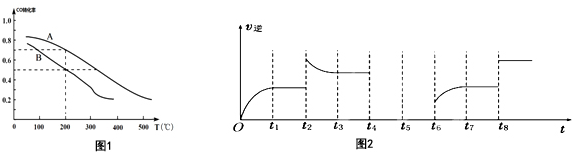
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.
(4)反应Ⅲ逆反应速率与时间的关系如图2所示:
①试判断t2时改变的条件是升高温度或增大生成物浓度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.
| A. | H2SO4→SO2 | B. | CO2→CO | C. | Cl2→HCl | D. | Na→NaCl |
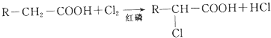
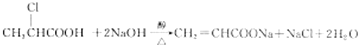 .
. .
. .
.