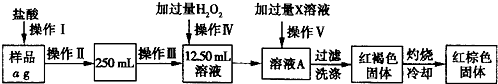
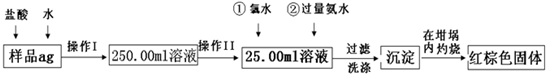
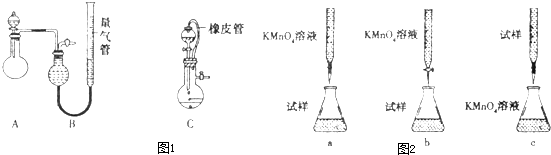
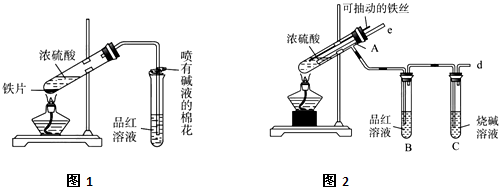
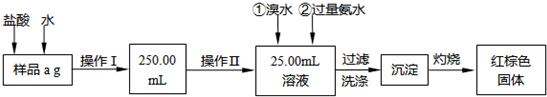
题目内容
|
4℃时某一滴管滴出30滴水,体积为a mL,则每滴水中所含的水分子数为 | |
A. |
|
B. |
|
C. |
|
D. |
|
答案:D
解析:
解析:
|
每滴水的体积为:a mL/30,每滴水的物质的量为:a mL/30×1 g·mL-1/18 g·mol-1=a/(30×18) mol,每滴水中所含的水分子数为: |

练习册系列答案
相关题目