题目内容
13.下列说法中,正确的是( )| A. | 任何钠盐放人水中均不水解 | |
| B. | 可溶性铝盐溶于水都能水解 | |
| C. | NaC1水解后溶液呈中性 | |
| D. | NaHCO3溶液中只存在水解平衡不存在电离平衡 |
分析 A.含有弱酸根离子的钠盐在水中发生水解;
B.铝离子、偏铝酸根离子都能够发生水解反应;
C.钠离子和氯离子都不发生水解反应;
D.碳酸氢根离子既能够电离又能够水解.
解答 解:A.不少钠盐能够发生水解反应,如碳酸钠、亚硫酸钠、碳酸氢钠等,故A错误;
B.可溶性铝盐能够电离出铝离子和偏铝酸根离子,铝离子和偏铝酸根离子都能够发生水解反应,故B正确;
C.NaCl为强酸强碱盐,溶液中的钠离子和氯离子都不发生水解反应,故C错误;
D.NaHCO3溶液中的碳酸氢根离子既能够发生水解反应,又能够电离,在溶液中存在水解平衡和电离平衡,故D错误;
故选B.
点评 本题考查了钠的化合物性质、盐的水解原理,题目难度不大,明确盐的水解原理为解答关键,注意掌握常见钠及其化合物性质,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,下列叙述中正确的是( )
| A. | Na2SO4和NaCl的物质的量之比为1:3 | |
| B. | 溶液中一定有1molNa2SO4和3molNaCl | |
| C. | 所带电荷数SO42-是Na+的0.6倍 | |
| D. | SO42-与Cl-的物质的量之和等于Na+的物质的量 |
4.下列溶液中有关微粒的物质的量浓度关系一定正确的是( )


| A. | c(NH+4)相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,pH大小:①>②>③ | |
| B. | 0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH=2的CH3COOH与pH=12的NaOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
5.将等物质的量的X2和Y2置于一密闭容器中,在一定条件下发生反应mX2(g)+nY2(g)═pZ(g),在某一时刻,测得容器中C(X2)=0.9mol•L-1,C(Y2)=0.1mol•L-1,C(Z)=0.8mol•L-1,则Z的化学式可能是( )
| A. | X2Y3 | B. | XY3 | C. | X2Y2 | D. | X3Y2 |
16.患甲状腺肿大的病人需补充的元素是( )
| A. | 铁元素 | B. | 钙元素 | C. | 碘元素 | D. | 镁元素 |
17.下列物质加入水中显著放热的是( )
| A. | 生石灰 | B. | 固体NaCl | C. | 蔗糖 | D. | 固体NH4NO3 |
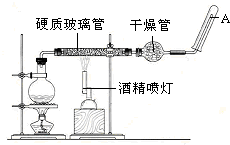 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,就可以完成高温下“Fe与水蒸气的反应实验”.请设计实验,证明还原铁粉与水蒸气能够发生反应.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,就可以完成高温下“Fe与水蒸气的反应实验”.请设计实验,证明还原铁粉与水蒸气能够发生反应.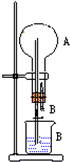 在图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.
在图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.