题目内容
现在有NH3、F2、Cl2、Na、Fe、Na2O、Na2O2、SO2、CO2、NO2等中学化学常见物质,根据它们与水是否发生氧化还原反应进行分类如下:
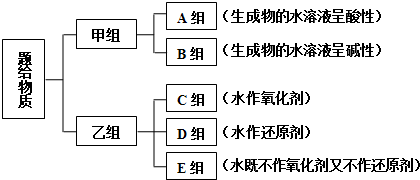
(1)淡黄色固体位于 组(填“A”→“E”),1mol该物质与足量水反应转移电子数为
(2)用电子式表示A组中溶解度较小物质的形成过程:
(3)C组中某物质须在高温时才能与水蒸气反应,其化学方程式为:
(4)写出B组中气体物质在工业上催化氧化的化学方程式: .

(1)淡黄色固体位于
(2)用电子式表示A组中溶解度较小物质的形成过程:
(3)C组中某物质须在高温时才能与水蒸气反应,其化学方程式为:
(4)写出B组中气体物质在工业上催化氧化的化学方程式:
考点:氧化还原反应,氮的氧化物的性质及其对环境的影响,二氧化硫的化学性质,常见金属元素的单质及其化合物的综合应用
专题:元素及其化合物
分析:(1)淡黄色固体是过氧化钠,过氧化钠和水反应方程式为2Na2O2+2H2O=4NaOH+O2↑,该反应过氧化钠中O元素化合价由-1价变为-2价和0价;
(2)A组中溶解度较小的物质为CO2,二氧化碳是碳原子分别和两个氧原子形成两对共用电子对形成的共价化合物;
(3)C组中某一物质须在加热时才能与水蒸汽反应,应为Fe;
(4)B组中气体物质在工业上催化氧化的为NH3,氨气被氧化生成NO和水.
(2)A组中溶解度较小的物质为CO2,二氧化碳是碳原子分别和两个氧原子形成两对共用电子对形成的共价化合物;
(3)C组中某一物质须在加热时才能与水蒸汽反应,应为Fe;
(4)B组中气体物质在工业上催化氧化的为NH3,氨气被氧化生成NO和水.
解答:
解:(1)淡黄色固体是过氧化钠,过氧化钠和水反应方程式为2Na2O2+2H2O=4NaOH+O2↑,氢氧化钠溶液呈碱性,该反应过氧化钠中O元素化合价由-1价变为-2价和0价,水中各元素化合价不变,所以水既不是氧化剂又不是还原剂,故选E;
1mol过氧化钠和水反应转移电子数=1mol×1×NA/mol=NA,
故答案为:E;NA;
(2)A 组中溶解度较小的物质为CO2,二氧化碳是碳原子分别和两个氧原子形成两对共用电子对形成的共价化合物,电子式形成过程为
故答案为: ;
;
(3)C组中某一物质须在加热时才能与水蒸汽反应,应为Fe,该反应方程式为4H2O(g)+3Fe
Fe3O4+4H2,故答案为:4H2O(g)+3Fe
Fe3O4+4H2;
(4)B组中气体物质在工业上催化氧化的为NH3,氨气被氧化生成NO和水,反应方程式为4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O.
1mol过氧化钠和水反应转移电子数=1mol×1×NA/mol=NA,
故答案为:E;NA;
(2)A 组中溶解度较小的物质为CO2,二氧化碳是碳原子分别和两个氧原子形成两对共用电子对形成的共价化合物,电子式形成过程为

故答案为:
 ;
;(3)C组中某一物质须在加热时才能与水蒸汽反应,应为Fe,该反应方程式为4H2O(g)+3Fe
| ||
| ||
(4)B组中气体物质在工业上催化氧化的为NH3,氨气被氧化生成NO和水,反应方程式为4NH3+5O2
| ||
| △ |
| ||
| △ |
点评:本题易氧化还原反应为载体考查了元素化合物知识,根据物质的性质分析解答即可,注意过氧化钠中O元素化合价,注意铁和水蒸气反应生成物,这些都是易错点,题目难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目

 化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
