题目内容
12.下列离子反应中,表达正确的是( )| A. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用铜作电极电解硫酸溶液:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| C. | 等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合时发生反应:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
分析 A.不符合反应客观事实;
B.铜为阳极属于活性电极,电极本身放电;
C.反应生成碳酸钡和氢氧化钠、水;
D.反应生成的硫酸钡为沉淀,应保留化学式.
解答 解:A.氯化铝的溶液中加入过量氨水的离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.用铜作电极电解硫酸溶液,离子方程式:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+Cu(OH)2↓,故B错误;
C.等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合时发生反应,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故C正确;
D.向BaCO3固体中加入过量的稀H2SO4,离子方程式:BaCO3+2H+═BaSO4↓+CO2↑+H2O,故D错误;
故选:C.
点评 本题离子方程式的书写,明确发生的反应是解答本题的关键,注意反应物用量对反应的影响,选项C为易错选项.

练习册系列答案
相关题目
2.“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用.下列化学反应不符合绿色化学概念的是( )
| A. | 用烧碱溶液消除制硝酸工业尾气的氮氧化物污染:NO2+NO+2NaOH═NaNO2+H2O | |
| B. | 制硝酸铜:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O | |
| C. | 制甲基丙烯酸甲酯(即有机玻璃): | |
| D. | 制硫酸铜:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O |
3.在测定中和反应的反应热的实验中不需要用到的仪器是( )
| A. | 量筒 | B. | 温度计 | C. | 环形玻璃搅拌棒 | D. | 天平 |
20.已知溴酸银的溶解是吸热过程,在不同温度下溴酸银溶解平衡曲线如图所示,下列说法正确的是( )
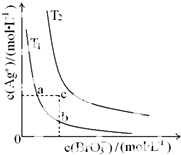

| A. | T1>T2 | |
| B. | 加入AgNO3固体,可使a点变到c点 | |
| C. | a点和b点的Ksp相等 | |
| D. | c点时,在T1、T2两个温度下均有固体析出 |
7.NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A. | 标准状况下,2.24 L CCl4中含有的分子数大于0.1NA | |
| B. | 常温下,1 mol/L Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 分子数为NA的C2H4气体体积约为22.4 L,该条件一定是标准状况 | |
| D. | 标准状况下,4.2 g C3H6中含有的碳碳双键数一定为0.1 NA |
17.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为NA | |
| B. | 标准状况下,22.4 L O2 作氧化剂时转移电子数一定为4NA | |
| C. | 10 L 0.1 mol/L 的Na2CO3溶液中,Na+、CO32-总数为3NA | |
| D. | 通常状况下,4.2 g丙烯中所含碳氢键数目为0.6 NA |
4.下列各组物质中既具有相同的最简式,又不属于同分异构体和同系物的是( )
①聚乙烯和乙烯 ②甲醛和葡萄糖 ③淀粉和纤维素④蔗糖和麦芽糖 ⑤聚乙烯和聚氯乙烯.
①聚乙烯和乙烯 ②甲醛和葡萄糖 ③淀粉和纤维素④蔗糖和麦芽糖 ⑤聚乙烯和聚氯乙烯.
| A. | ①②④⑤ | B. | ①②③ | C. | ①③④⑤ | D. | ①②③⑤ |
1.欲证明一瓶无色液体是纯水,可靠的实验方法是( )(已知常温时,水的离子积为10-14,pH=7,NaCl溶解度为36g,加热时水易挥发)
| A. | 100℃时Kw=10-12 | |
| B. | 加热蒸干后无任何残留物 | |
| C. | 常温100g该液体中最多溶解NaCl固体36g | |
| D. | 常温下,阳离子总浓度c=10-7mol/L |