题目内容
已知t℃时,纯水中[H+]=2×10-7 mol·L-1,在该温度下Mg(OH)2的溶度积Ksp[Mg(OH)2]=3.2×10-11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为多少?
10
解析:
:Mg(OH)2(s)?Mg2+(aq)+2(OH)-(aq) Ksp[Mg(OH)2]=3.2×10-11mol3·L-3
设[Mg2+]为x则:[OH-]为2x
Ksp[Mg(OH)2] = [Mg2+]·[OH-]2
=x·(2x)2=3.2×10-11mol3·L-3
解得:x=2×10-4 mol·L-1
所以[OH-]=2x=4×10-4 mol·L-1
由于纯水中[OH-]=[H+]=2×10-7 mol·L-1
所以Kw=[H+]·[OH-]=4×10-14 mol2·L-2
在饱和的Mg(OH)2溶液中![]() =1×10-10 mol·L-1
=1×10-10 mol·L-1
pH=-lg[H+]=-lg(1×10-10)
=10

练习册系列答案
相关题目
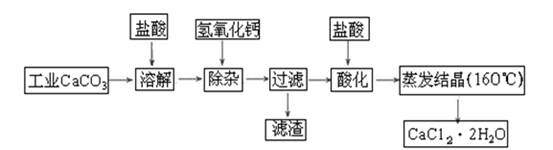 (1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
(1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
 ______________,
______________, 11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。