��Ŀ����
��8�֣�����Ũ�Ⱦ�Ϊ0.1 mol/L��������Һ�������� �ڴ��� ���������� ���Ȼ�梨������� ��̼�����ơ���ش��������⣺
(1)�٢ڢۢ�������Һ����ˮ�������H��Ũ���ɴ�С��˳���� ������ţ���
(2)��֪T�棬��ˮ��c(H+)=1��10-6.5 mol��L-1����T�� �������������������������25�档��T��ʱ����pH = 11�Ģ���Һa L��pH = 1�Ģ���Һb L��ϣ����Ի�Ϻ���Һ����ı仯������������Һ��pH = 10����a��b = ��
(3)������Һ�͢���Һ���ʱ���ɿ�����ʵ�������� ,�����������ԭ���� �������ӷ���ʽ����ԭ��
(1) �ܣ��ڣ��ۣ��� ��(2) T�� �� a��b ��101 : 9 ��
(3) ������ɫ����ͬʱ������ɫ���� ��Al3+ +3HCO3�� ==3CO2�� +Al(OH)3��
����������1�������е������ӻ�OH��Ũ��Խ��ˮ������Խ���Ȼ��ˮ��ٽ�ˮ�ĵ��룬���Ԣ٢ڢۢ�������Һ����ˮ�������H��Ũ���ɴ�С��˳��Ӧ���Ǣܣ��ڣ��ۣ��١�
��2���������ȣ����ȴٽ�ˮ�ĵ��룬������Ũ���������T�棾25�档������Һ��pH = 10�������������ǹ����ģ���Ӧ����Һ��������Ũ��10��10mol/L����OH��Ũ����10��13��10��10��0.001mol/L������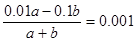 �����a��b ��101 : 9��
�����a��b ��101 : 9��
��3��������ˮ�������ԣ�̼������ˮ���Լ��ԣ����Զ���Ϻ�ˮ����ٽ���������������������CO2���壬����ʽΪAl3+ +3HCO3�� ==3CO2�� +Al(OH)3����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�