题目内容
2.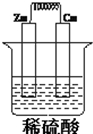 如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空
如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空(1)锌为:负极极(填“正”或“负”)电极反应式为:Zn-2e-=Zn2+,
(2)反应过程中电流的方向为:A
A 由铜流向锌 B 由锌流向铜
(3)若有锌片质量减少了0.65g,则转移了0.02mol电子发生转移,铜片上产生气体的体积(标况下)为:0.224L.
分析 该原电池中,Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为2H++2e-=H2↑,导致负极上金属逐渐减少,正极上有气泡产生,电流从正极流向负极,据此分析解答.
解答 解:(1)该原电池中,Zn易失电子作负极、Cu作正极,负极上铁失电子发生氧化反应生成锌离子进入溶液,电极反应式为Zn-2e-=Zn2+,故答案为:负极;Zn-2e-=Zn2+;
(2)Zn易失电子作负极、Cu作正极,反应过程中电流的方向为从正极流向负极,故答案为:A;
(3)正极反应为:2H++2e-=H2↑,当锌片溶解0.65g时,即消耗Zn为0.01mol,转移电子为0.02mol,则铜上生成的氢气为0.01mol,在标准状况下体积为0.224L,故答案为:0.02;0.224.
点评 本题主要考查了原电池及计算,明确正负极的判断方法及电极上发生的反应是解本题关键,根据电极反应确定发生的现象,题目难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
13.下列实验中,不能观察到明显现象的是( )
| A. | 把绿豆大的钾投入水中 | |
| B. | 把除去氧化膜的镁带放入少量冷水中 | |
| C. | 把溴水滴加到KI溶液中,并加入少量四氯化碳溶液 | |
| D. | 把铜片和铁片紧靠在一起浸入稀硫酸中 |
10.保护环境已成为当前和未来的全球性的重大课题之一,下列因为人类生产对环境破坏而带来的后果是( )
①土地沙漠化 ②酸雨 ③水资源危机 ④南极上抽样空洞 ⑤沙尘暴.
①土地沙漠化 ②酸雨 ③水资源危机 ④南极上抽样空洞 ⑤沙尘暴.
| A. | ①②⑤ | B. | ①②④⑤ | C. | ②⑤ | D. | ①②③④⑤ |
17.在密闭容器中进行如下可逆反应:X2(g)+Y2(g)?2XY(g),已知X2,Y2,XY三者起始浓度分别为0.1mol/L,0.3mol/L,0.2mol/L,在一定条件下反应处于平衡,此时容器中不可能出现的情况是( )
| A. | X2为0.2mol/L | B. | Y2为0.35mol/L | ||
| C. | XY为0.25mol/L | D. | X2,Y2,XY总浓度为0.6mol/L |
14.下列各组物质中,互为同系物的是( )
| A. |  与 与 | B. |  与 与 | C. | 硬脂酸与油酸 | D. | 甲醇与乙二醇 |
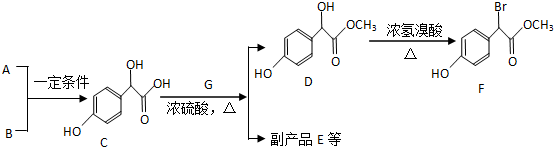
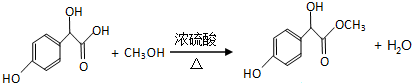
 .
.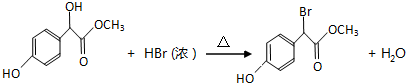
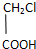
 .
.
 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.