题目内容
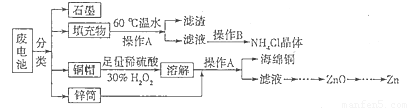
废旧电池进入环境后,对人体带来一系列的致畸、致癌、致变等危害.废电池中主要有铜帽 (含 Cu、Zn)、锌壳、铁片、石墨、填充物 (MnO2、NH4Cl),以下是对废旧电池进行资源化处理的方法.

(1)操作A的名称为 ,滤渣的成分为 .
(2)填充物用 60℃温水溶解,目的是为了加快溶解速率,但必须控制温度不能太高,其原因是 .
(3)铜帽溶解时加入 H202的目的是(用化学方程式表示) .铜帽溶解完全后,需将溶液中过量的H202除去.除去H202的简便方法是 .
(4)碱性锌锰电池的电解质为KOH,总反应为:Zn+2MnO2+2H20=2MnOOH+Zn(OH)2,其负极的电极方程式为 .

(1)操作A的名称为
(2)填充物用 60℃温水溶解,目的是为了加快溶解速率,但必须控制温度不能太高,其原因是
(3)铜帽溶解时加入 H202的目的是(用化学方程式表示)
(4)碱性锌锰电池的电解质为KOH,总反应为:Zn+2MnO2+2H20=2MnOOH+Zn(OH)2,其负极的电极方程式为
分析:(1)依据流程转化关系,结合废电池中主要有铜帽 (含 Cu、Zn)、锌壳、铁片、石墨、填充物 (MnO2、NH4Cl),可知填充物质中氯化铵溶于水,二氧化锰不溶于水;,分离固体和 溶液的方法是过滤;
(2)温度过高氯化铵分解;
(3)铜和稀硫酸不反应,加入过氧化氢是氧化剂,能在酸性溶液中氧化铜发生反应;过氧化氢加热分解生成氧气和水;
(4)原电池负极电极反应是失电子发生氧化反应,注意电解质溶液是碱溶液.
(2)温度过高氯化铵分解;
(3)铜和稀硫酸不反应,加入过氧化氢是氧化剂,能在酸性溶液中氧化铜发生反应;过氧化氢加热分解生成氧气和水;
(4)原电池负极电极反应是失电子发生氧化反应,注意电解质溶液是碱溶液.
解答:解:(1)废电池中主要有铜帽 (含 Cu、Zn)、锌壳、铁片、石墨、填充物 (MnO2、NH4Cl),回收利用的流程图中,把填充物在60°的水中处理,二氧化锰难溶于水,氯化铵溶于水,通过过滤分离得到滤渣为二氧化锰,滤液为氯化铵溶液;
故答案为:过滤;MnO2;
(2)填充物用 60℃温水溶解,目的是为了加快溶解速率,但必须控制温度不能太高,由于氯化铵受热温度过高会分解生成氨气和氯化氢,所以控制温度不能过高;
故答案为:温度过高氯化铵受热分解;
(3)铜和稀硫酸不反应,酸性条件下过氧化氢具有较强氧化性,可以把铜氧化,反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;铜帽溶解完全后,需将溶液中过量的H202除去,可以用加热的方法使过氧化氢分解生成水和氧气除去,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热;
(4)碱性锌锰电池的电解质为KOH,总反应为:Zn+2MnO2+2H20=2MnOOH+Zn(OH)2,负极是失电子发生氧化反应的物质,依据电池反应,锌失电子发生氧化反应,在碱性环境中生成氢氧化锌,电极反应式为:Zn+2OH--2e-=Zn(OH)2,故答案为:Zn+2OH--2e-=Zn(OH)2 .
故答案为:过滤;MnO2;
(2)填充物用 60℃温水溶解,目的是为了加快溶解速率,但必须控制温度不能太高,由于氯化铵受热温度过高会分解生成氨气和氯化氢,所以控制温度不能过高;
故答案为:温度过高氯化铵受热分解;
(3)铜和稀硫酸不反应,酸性条件下过氧化氢具有较强氧化性,可以把铜氧化,反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;铜帽溶解完全后,需将溶液中过量的H202除去,可以用加热的方法使过氧化氢分解生成水和氧气除去,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热;
(4)碱性锌锰电池的电解质为KOH,总反应为:Zn+2MnO2+2H20=2MnOOH+Zn(OH)2,负极是失电子发生氧化反应的物质,依据电池反应,锌失电子发生氧化反应,在碱性环境中生成氢氧化锌,电极反应式为:Zn+2OH--2e-=Zn(OH)2,故答案为:Zn+2OH--2e-=Zn(OH)2 .
点评:本题考查了废电池的回收利用实验流程分析,主要是物质性质的应用,原电池电极反应的书写方法,题目难度中等.

练习册系列答案
相关题目