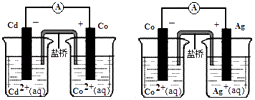
题目内容
【题目】海带中含有丰富的碘元素,某学习小组设计如下实验流程提取海带中的碘,请回答下列问题:
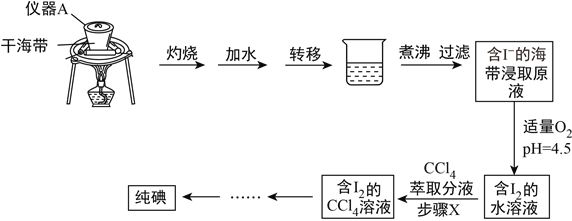
(1)仪器A的名称为__________________,实验室取用仪器A必须使用_________。
(2)煮沸的作用是______________________。
(3)步骤X中,使用了分液漏斗。分液漏斗使用前,须进行的操作是__________;萃取后,分液漏斗内观察到的现象是___________;分液时,为了保证液体顺利留下,应首先_________。
(4)向海带浸取原液中通入适量O2,并控制溶液pH为4.5,此时发生反应的离子反应方程式为:__________________________________________。
(5)某同学欲采用蒸馏含I2的CCl4溶液得到纯碘,此方案不合理,理由是_____________。
【答案】 坩埚 坩埚钳 使碘离子充分溶解在水中 检漏 分液漏斗内溶液分层,上层基本无色,下层显紫色 打开塞子 4I-+O2+4H+=2I2+2H2O 碘易挥发,蒸馏后不能得到碘单质。
【解析】(1)仪器A的名称为坩埚,实验室取用坩埚必须使用坩埚钳。(2)由于后续得到含有碘离子的溶液,因此煮沸的作用是使碘离子充分溶解在水中;(3)分液漏斗使用前,须进行的操作是检漏;碘易溶在四氯化碳中,且四氯化碳的密度大于水,所以萃取后,分液漏斗内观察到的现象是分液漏斗内溶液分层,上层基本无色,下层显紫色;分液时,为了保证液体顺利留下,需要保持内外压强相等,则应首先打开塞子。(4)氧气具有氧化性,能把碘离子氧化为单质碘,此时发生反应的离子反应方程式为4I-+O2+4H+=2I2+2H2O;(5)由于碘易挥发,所以蒸馏后不能得到碘单质,因此此方案不合理。

练习册系列答案
相关题目