题目内容
【题目】填空题
(1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): 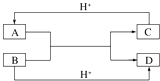
①如果A、B、C、D均是10电子的粒子,请写出:A电子式:;D的结构式: .
②如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:A与B在溶液中反应的离子方程式为 . 根据上述离子方程式,可以判断C与B结合质子的能力大小是 . (用化学式或离子符号表示).
(2)另一10电子物质,相同条件下对H2的相对密度为8,常温常压下,3.2g该物质与足量氧气充分燃烧后放出akJ热量,(a>0).写出该物质燃烧热的热化学方程式: .
将3.2g该物质燃烧后的产物通入100mL3molL﹣1的NaOH溶液中,充分反应后所得的溶液中离子浓度大小关系为: .
【答案】
(1) ;H﹣O﹣H;HS﹣+OH﹣═S2﹣+H2O;OH﹣>S2﹣
;H﹣O﹣H;HS﹣+OH﹣═S2﹣+H2O;OH﹣>S2﹣
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣5akJ?mol﹣1;Na+>HCO3﹣>CO32﹣>OH﹣>H+
【解析】解:(1.)①10电子微粒A、B反应得到两种10电子微粒,应是铵根离子与氢氧根离子反应得到氨气与水,而C、B都能与氢离子反应,可推知A为NH4+ , B为OH﹣ , C为NH3 , D为H2O,NH4+的电子式为  ,H2O结构式为H﹣O﹣H,
,H2O结构式为H﹣O﹣H,
所以答案是:  ;H﹣O﹣H;
;H﹣O﹣H;
②如果A、C均是18电子的粒子,B、D是10电子粒子,结合转化关系,可推断:A为H2S,B为OH﹣ , C为HS﹣或S2﹣ , D为H2O,A与B在溶液中反应的离子方程式为:HS﹣+OH﹣═S2﹣+H2O,根据离子方程式,可以判断结合质子的能力大小是OH﹣>S2﹣ , 所以答案是:HS﹣+OH﹣═S2﹣+H2O;OH﹣>S2﹣;
(2.)另一10电子物质,相同条件下对H2的相对密度为8,则该物质相对分子质量为16,则该物质为CH4 , 1mol甲烷燃烧放出的热量为akJ× ![]() =5a kJ,反应热书写热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣5akJmol﹣1;
=5a kJ,反应热书写热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣5akJmol﹣1;
3.2g甲烷物质的量为 ![]() =0.2mol,则燃烧生成二氧化碳为0.2mol,NaOH物质的量为0.1L×3mol/L=0.3mol,由于1:2<n(CO2):n(NaOH)=2:3<1:1,而生成NaHCO3、Na2CO32 , 设二者物质的量分别为xmol、ymol,根据钠离子守恒、碳原子守恒可得:
=0.2mol,则燃烧生成二氧化碳为0.2mol,NaOH物质的量为0.1L×3mol/L=0.3mol,由于1:2<n(CO2):n(NaOH)=2:3<1:1,而生成NaHCO3、Na2CO32 , 设二者物质的量分别为xmol、ymol,根据钠离子守恒、碳原子守恒可得: ![]() ,解得x=y=0.1,结合溶液中HCO3﹣、CO32﹣水解呈碱性,且碳酸根离子水解程度大于碳酸氢根的,故溶液中离子浓度大小为:Na+>HCO3﹣>CO32﹣>OH﹣>H+ ,
,解得x=y=0.1,结合溶液中HCO3﹣、CO32﹣水解呈碱性,且碳酸根离子水解程度大于碳酸氢根的,故溶液中离子浓度大小为:Na+>HCO3﹣>CO32﹣>OH﹣>H+ ,
所以答案是:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣5akJmol﹣1; Na+>HCO3﹣>CO32﹣>OH﹣>H+ .

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案