��Ŀ����
����Ŀ������������Ҫ�ɷ���![]() ����
����![]() ��
��![]() ��MgO�����ʣ�����ȡ���ֹ���Ʒ���������£�
��MgO�����ʣ�����ȡ���ֹ���Ʒ���������£�
��ش��������⣺
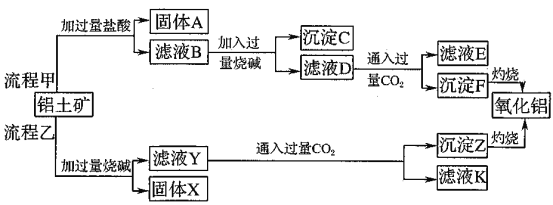
��1�����̼������������Al3+�ķ���ʽΪ_________.
��2�������Ҽ����ռ������SiO32-�����ӷ���ʽΪ________.
��3����֤��ҺB��![]() ����ȡ������Һ������________�����Լ����ƣ���
����ȡ������Һ������________�����Լ����ƣ���
��4����ҺE��K�����ʵ���Ҫ�ɷ���________(�ѧʽ)��д������Һ��һ����;________
��5����֪298Kʱ��![]() ���ݶȻ�����
���ݶȻ�����![]() =5.6��
=5.6��![]() ,ȡ��������ҺB,����һ�������ռ�ﵽ������Һƽ�⣬���PH=13.00������¶��²�������Һ�е�
,ȡ��������ҺB,����һ�������ռ�ﵽ������Һƽ�⣬���PH=13.00������¶��²�������Һ�е�![]() =_______.
=_______.
���𰸡�Al2O3+ 6H��=2Al3��+3H2O SiO2+ 2OH��=SiO32��+ H2O ���軯�أ���������ء�������Һ�Ⱥ����𰸣� NaHCO3 �ƴ���������ͷ۵Ⱥ����� 5.6��10-10mol/L
��������
��1����HCl��Ӧ����Al3����ӦΪ��������Al2O3��Al2O3�����ᷴӦ�����ӷ���ʽΪ��Al2O3+ 6H��=2Al3��+3H2O��
�ʴ�ΪAl2O3+ 6H��=2Al3��+3H2O��
��2��SiO2��������NaOH������Na2SiO3�����ӷ���ʽΪ��SiO2+ 2OH��=SiO32��+ H2O��
�ʴ�ΪSiO2+ 2OH��=SiO32��+ H2O��
��3������Fe3����������Ӧ�ܶ࣬����KSCN��Ѫ��ɫ���뱽������ɫ����OH���Ժ��ɫ�����ȡ�
�ʴ�Ϊ���軯�أ���������ء�������Һ�Ⱥ����𰸣���
��4������E��Kʱ��CO2���ǹ����ģ���Ӧ����NaHCO3���������ƴ���������ͷۣ�
�ʴ�ΪNaHCO3���ƴ���������ͷ۵Ⱥ����𰸣�
��5��pH=13.00��c(OH-)=0.1mol/L������![]() ����
����![]() =5.6��10-12/(0.1)2=5.6��10-10��
=5.6��10-12/(0.1)2=5.6��10-10��
�ʴ�Ϊ5.6��10-10mol/L��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��������Դ�Ŀ��������þ��й�����ǰ������ˮ��pHһ����7.5~8.6֮�䡣ij�غ�ˮ����Ҫ���ӵĺ������±���
�ɷ� | Na+ | K+ | Ca2+ | Mg2+ | Cl�� | SO42�� | HCO3�� |
����/mgL��1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
��1����ˮ�������Ե�ԭ���ǣ������ӷ���ʽ��ʾ����____________���ú�ˮ��Ca2+�����ʵ���Ũ��Ϊ__________mol/L ��
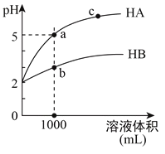
��2�����������ǽ��귢չ������һ�ֽϺõĺ�ˮ������������ԭ������ͼ��ʾ�����������������ӽ���Ĥֻ����������������ͨ�����缫��Ϊ���Ե缫��

�� ��ʼʱ�����ĵ缫��ӦʽΪ________________��
�� ���һ��ʱ�䣬____���������������������������ˮ������ɷ�Ϊ_____���ѧʽ����
�� ��ˮ�ij���Ϊa��b��c�е�__________���ڡ�
��3����ˮ���Ԫ�ش����dz��ḻ���Ӻ�ˮ����ȡ﮵��о�����DZ����������컯ѧ��Դ����Ҫԭ�ϣ���LiFePO4���ij�缫�Ĺ���ԭ����ͼ��ʾ��

�õ�ص����Ϊ�ܴ��� Li+�Ĺ�����ϡ�
������ͼ�е�С�ڵ��ʾ_____�������ӷ��ţ������ʱ�õ缫��ӦʽΪ_______��
��4�����ú�����Դ�ɻ��MnO2 ��MnO2�������Ʊ�������أ���MnO2��KOH��Ϻ��ڿ����м������ڣ��õ���ɫ������أ�K2MnO4��������������������������ɸ�����ء����Ʊ�������������ͬ�����������Ϳ����������Ϊ_________�����������������������20%�ƣ���
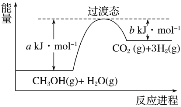
����Ŀ��ij�¶��£���Ӧ2A��g��![]() B��g��+C��g����ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2 L���ܱ������м���A��g����20 sʱ��ø���ֵ����ʵ������±���
B��g��+C��g����ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2 L���ܱ������м���A��g����20 sʱ��ø���ֵ����ʵ������±���
�� �� | A��g�� | B��g�� | C��g�� |
���ʵ���/mol | 1.2 | 0.6 | 0.6 |
����˵����ȷ���ǣ� ��
A. ��Ӧǰ20 s��ƽ������Ϊv��A��=0.6 mol��L-1��s-1
B. 20 sʱ������Ӧ���ʵ����淴Ӧ����
C. ��ƽ��ʱ��A��g����ת����Ϊ100%
D. �������¶ȣ�ƽ�ⳣ����Ϊ0.6����Ӧ����H��0