题目内容
1.一定条件下的密闭容器中:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.9kJ•mol-1,下列叙述正确的是( )| A. | 4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ | |
| B. | 平衡时,$\frac{4}{5}$v正(O2)=v正(NO) | |
| C. | 平衡后降低压强,混合气体平均摩尔质量增大 | |
| D. | 平衡后升高温度,混合气体中NO含量降低 |
分析 A.为可逆反应,不能完全转化;
B.平衡时,不同正逆物质的速率之比等于化学计量数之比;
C.该反应为气体体积增大的反应,平衡后降低压强,平衡正向移动,n增大,结合M=$\frac{m}{n}$判断;
D.该反应为放热反应,升高温度,平衡逆向移动.
解答 解:A.为可逆反应,不能完全转化,则4 mol NH3和5 mol O2反应,达到平衡时放出热量小于905.9 kJ,故A错误;
B.平衡时,不同物质的正逆速率之比等于化学计量数之比,则平衡时,$\frac{4}{5}$v正(O2)=v逆(NO),故B错误;
C.该反应为气体体积增大的反应,平衡后降低压强,平衡正向移动,由M=$\frac{m}{n}$可知,n增大,m不变,混合气体平均摩尔质量减小,故C错误;
D.该反应为放热反应,升高温度,平衡逆向移动,则混合气体中NO含量降低,故D正确;
故选D.
点评 本题考查化学平衡,为高频考点,把握可逆反应、平衡判定、平衡移动为解答的关键,侧重分析与应用能力的考查,注意物质的量与热量的关系,题目难度不大.

练习册系列答案
相关题目
3.下列关于有机物的命名中不正确的是( )
| A. | 2?2-二甲基戊烷 | B. | 2-乙基戊烷 | C. | 2?3-二甲基戊烷 | D. | 3-乙基己烷 |
16.下列说法正确的是( )
| A. | 煤的干馏可以得到苯、甲苯等芳香烃 | |
| B. | 防腐剂福尔马林(含HCHO)可用作食品保鲜剂 | |
| C. | “乙醇汽油”是在汽油中加入乙醇生成的一种新化合物 | |
| D. | 风化、潮解、煤的气化、煤的液化和石油分馏等都是物理变化 |
6.下列离子方程式中,属于水解反应的是( )
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO2+H2O?HCO3-+H+ | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | HS-+H2O?S2-+H3O+ |
13.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而减小 | |
| B. | 单质的颜色随核电荷数的增加而加深 | |
| C. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而减弱 |
10.下列有关叙述不正确的是( )
| A. | 有机玻璃和尼龙是高分子化合物,钢化玻璃不是高分子化合物 | |
| B. | 工业上通过裂解反应可提高从石油中得到汽油等轻质油的产量和质量 | |
| C. | 二氧化碳和环氧丙烷在催化剂作用下可生成一种可降解的塑料 | |
| D. | 人从食物中摄取的蛋白质在人体内先水解成各种氨基酸,各种氨基酸又能彼此结合成人体需要的蛋白质 |
11.在同温、同压下,相同体积的下列气体中,质量最小的是( )
| A. | CH4 | B. | N2 | C. | CO2 | D. | H2 |

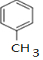 ,D中通过反应②引入的官能团名称为氯原子.
,D中通过反应②引入的官能团名称为氯原子.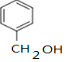 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O. (填结构简式).
(填结构简式).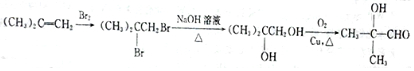 .
.