题目内容
2.氮及其化合物在生活和生产中应用广泛.(1)合成氨用的H2可以CH4为原料制得.有关化学反应的能量变化如图1所示.则CH4(g) 与H2O(g)反应生成CO(g)和H2(g)的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ.mol-1.
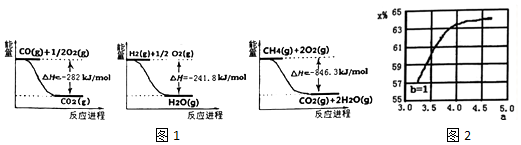
(2)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+C〇2(g)?CO(NH2)2(l)+H2O(g). 如图2为合成塔中不同氨碳比a[$\frac{n(N{H}_{3})}{n(C{O}_{2})}$]和水碳比b[$\frac{n({H}_{2}O)}{n(C{O}_{2})}$]时二氧化碳转化率(x%)请画出在相同条件下,a=3.5〜4.5范围内,b[$\frac{n({H}_{2}O)}{n(C{O}_{2})}$]=1.5时的二氧化碳转化率(x)的曲线图.
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业生产NaN3主要是在I75℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式NaNO3+3NaNH2=NaN3+3NaOH+NH3.
(4)叠氮酸(HN3)是一种一元弱酸,在水溶液中存在:HN3?H++N3-常温下将amolNaN3加入到bLcmol/L的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=$\frac{a×1{0}^{-7}}{bc}$(用含字母的代数式表示,忽略溶液体积变化).
(5)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物.以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式2HNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$2NH2OH+3O2↑.
分析 (1)依据图象分析反应过程都是能量降低的过程,说明反应是放热反应;写出对应热化学方程式,依据盖斯定律计算得到所需热化学方程式;
(2)根据氨碳比a[$\frac{n(N{H}_{3})}{n(C{O}_{2})}$]越大,二氧化碳转化率增大,水碳比b[$\frac{n({H}_{2}O)}{n(C{O}_{2})}$]越小,二氧化碳转化率增大分析;
(3)据原子守恒分析,把NaNO3粉末加到熔化的NaNH2中,生成的两种常见的碱性物质应为NaOH和NH3;
(4)叠氮酸(HN3)是一种一元弱酸,HN3的电离平衡常数Ka=$\frac{[{H}^{+}]•[{{N}_{3}}^{-}]}{[H{N}_{3}]}$,据此分析;
(5)汞电极上NO3-可转化为NH2OH,该电极上得电子发生还原反应,为阴极,则Pt是阳极,水得电子生成氧气和氢离子,在得失电子相同的条件下将两极电极反应式相加即得电池反应式.
解答 解:(1)图象分析反应过程都是能量降低的过程,反应的热化学方程式为:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282KJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
由盖斯定律③-②×3-①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1 kJ.mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1 kJ.mol-1;
(2)氨碳比a[$\frac{n(N{H}_{3})}{n(C{O}_{2})}$]越大,水碳比b[$\frac{n({H}_{2}O)}{n(C{O}_{2})}$]越小,二氧化碳转化率增大,所以a=3.5〜4.5范围内,b[$\frac{n({H}_{2}O)}{n(C{O}_{2})}$]=1.5时的二氧化碳转化率(x)的曲线图为 ,故答案为:
,故答案为: ;
;
(3)把NaNO3粉末加到熔化的NaNH2中,除生成叠氮酸钠(NaN3)外,生成的两种常见的碱性物质应为NaOH和NH3,故化学方程式为NaNO3+3NaNH2=NaN3+3NaOH+NH3,故答案为:NaNO3+3NaNH2=NaN3+3NaOH+NH3;
(4)将amolNaN3加入到bLcmol/L的HN3溶液中,所得溶液呈中性,所以c(N3-)=$\frac{a}{b}$mol/L,c(HN3)=cmol/L,c(H+)=10-7mol/L,HN3的电离平衡常数Ka=$\frac{[{H}^{+}]•[{{N}_{3}}^{-}]}{[H{N}_{3}]}$=$\frac{a×1{0}^{-7}}{bc}$,故答案为:$\frac{a×1{0}^{-7}}{bc}$;
(5)汞电极上NO3-可转化为NH2OH,该电极上得电子发生还原反应,为阴极,则Pt是阳极,水得电子生成氧气和氢离子,负极反应式为NO3-+6e-+7H+=NH2OH+2H2O、正极反应式为2H2O-4e-=O2↑+4H+,则电池反应式为2HNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$2NH2OH+3O2↑,
故答案为:2HNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$2NH2OH+3O2↑.
点评 本题考查了热化学方程式、影响化学平衡的因素、图象分析、化学平衡常数的计算、电解方程式书写,平衡常数概念的分析应用是解题关键,侧重分析与应用能力的综合考查,题目难度中等.

| A. | CaCl2,、Na2CO3 | B. | Na2CO3、NaI | ||
| C. | CaCl2、Na2CO3、NaI | D. | CaCl2、NaI |
| A. | NaHSO4 | B. | NH4Cl | C. | SO2 | D. | H2SO4 |
| A. | 正极反应式为:O2+4e-+2H2O=4OH- | |
| B. | 工作一段时间后,电解液中硫酸的物质的量浓度不变 | |
| C. | 通氢气的电极上发生还原反应 | |
| D. | 溶液中氢离子流向通氧气的电极 |
| A. | 运用蒸馏的方法,可以分离沸点相差较大的固体混合物 | |
| B. | 铁的化合物应用十分广泛,如FeCl3、FeSO4是优良的净水剂 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 工业上以氯气和石灰乳为原料制造漂白粉,漂白粉主要成分为Ca(ClO)2和CaCl2 |
| A. | K+、NO3-、AlO2-、Na+ | B. | NH4+、SO42-、CO32-、NO3- | ||
| C. | Mg2+、Fe3+、Cl-、SCN- | D. | K+、Ca+、Cl-、HCO3- |
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | HNO3的摩尔质量是63g | |
| C. | 我们把含有6.02×1023个粒子的任何粒子的集体计量为1摩尔 | |
| D. | 1mol氧含6.02×1023个O2 |
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液稀释至10倍后pH=4 | |
| C. | 0.2 mol/L的盐酸与0.1 mol/L的盐酸等体积混合后pH=1.5 | |
| D. | 若向氨水中加入等浓度稀盐酸至溶液正好呈中性,则所用稀盐酸的体积一定小于氨水的体积 |