题目内容
11.下列图象描述正确的是( )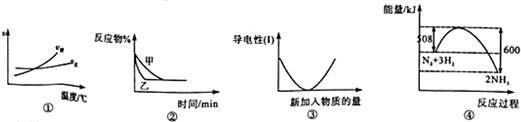
| A. | 根据图①可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H>0 | |
| B. | 图②可以表示压强对可逆反应“2A(g)+2B(g)?3C(g)+D(s)”的影响,乙的压强大 | |
| C. | 图③可表示硫酸溶液中滴加氢氧化钡溶液至过量过程中溶液导电性的变化 | |
| D. | 图④是N2与H2合成氨的能量变化曲线,可确定该反应,1molN2和3molH2充分反应时放热一定等于92kJ |
分析 A、根据图①可知,交点之前,反应未达平衡,交点时处于平衡状态,交点后增大温度逆反应速率增大比正反应速率增大更多,平衡向逆反应移动;
B、由图②可知,由甲到乙,到达平衡时间缩短,说明条件改变是乙的速率加快,平衡时反应物的转化率不变,改变条件变化不移动;
C、电解质溶液的导电能力与溶液离子的浓度有关,由图可知,随物质的加入导电能力降低到最低后又增大;
D、N2与H2合成氨为可逆反应,不可能反应到底.
解答 解:A.根据图①可知,交点之前,反应未达平衡,交点时处于平衡状态,交点后增大温度逆反应速率增大比正反应速率增大更多,平衡向逆反应移动,升高温度平衡向吸热反应移动,故可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应△H<0,故A错误;
B.由图②可知,由甲到乙,到达平衡时间缩短,说明条件改变是乙的速率加快,平衡时反应物的转化率不变,改变条件变化不移动,对可逆反应2A(g)+2B(g)?3C(g)+D(s)来说,反应前后气体体积减小,所以增大压强平衡向正反应方向移动,故B错误;
C.硫酸溶液中滴加氢氧化钡溶液生成硫酸钡和水,导电能力降低到最低,后氢氧化钡溶液过量,导电能力增强,与图象相符,故C正确;
D.N2与H2合成氨为可逆反应,不可能反应到底,所以1molN2和3molH2充分反应时放热一定小于92kJ,故D错误;
故选C.
点评 本题考查化学平衡的有关图象、电解质溶液导电能力、能量变化等,难度中等,是对知识的综合考查,注意分析图中曲线的变化特点.

练习册系列答案
相关题目
14.常温常压下,10mL某气态烃与50mL氧气混合点燃爆炸,恢复到原来状况时,体积变为35mL.该烃的化学式可能是( )
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C4H6 |
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA | |
| B. | pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.1 mol Na2O2晶体中含有0.3NA个离子 | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
6.今有氢、氧、氮、钠、钙、氟、氯、铜、钴9种元素.
(1)钴位于周期表四周期VIII族.
(2)用“>”、“<”填写下表
(3)铜能与浓盐酸缓慢发生置换反应,有配合物H[CuCl2]生成.
①该反应的化学方程式为2Cu+4HCl(浓)=2H[CuCl2]+H2↑.
②H[CuCl2]在空气中久置会生成含[Cu(H2O)4]2+的蓝色溶液,1mol[Cu(H2O)4]2+中含σ键数目为12NA.
(1)钴位于周期表四周期VIII族.
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 沸点 | |
| O <N | Cl <F | NaCl <CaO | HF >HCl |
①该反应的化学方程式为2Cu+4HCl(浓)=2H[CuCl2]+H2↑.
②H[CuCl2]在空气中久置会生成含[Cu(H2O)4]2+的蓝色溶液,1mol[Cu(H2O)4]2+中含σ键数目为12NA.
16.构造原理揭示的电子排布能及顺序,实质是各能级能量高低顺序.则下列能级的能量高低顺序正确的是( )
| A. | 5s>4f>4s>3d | B. | 3d>4s>3p>3s | C. | 4s>3s>2s>1s | D. | 5s>4s>4f>3d |
3.下列说法中不正确的是( )
| A. | 用完的电池不可以随意地丢弃 | |
| B. | 增加炼铁高炉的高度可以降低尾气中CO的含量 | |
| C. | 加入催化剂可以大大提高化学反应速率 | |
| D. | 把煤粉碎后再燃烧可以提高煤的燃烧效率 |
20. 右图是用比例模型来表示某物质发生化学变化的微观示意图.图中
右图是用比例模型来表示某物质发生化学变化的微观示意图.图中 和
和 分别表示两种元素的原子,能用该图表示的化学反应是( )
分别表示两种元素的原子,能用该图表示的化学反应是( )
 右图是用比例模型来表示某物质发生化学变化的微观示意图.图中
右图是用比例模型来表示某物质发生化学变化的微观示意图.图中 和
和 分别表示两种元素的原子,能用该图表示的化学反应是( )
分别表示两种元素的原子,能用该图表示的化学反应是( )| A. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | B. | 2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO | ||
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | D. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 |
1.下列分子中,所有原子最外层均为8电子结构的是( )
| A. | BeCl2 | B. | H2S | C. | PCl3 | D. | SF6 |