题目内容
1.下列变化,应加入还原剂才能实现的是( )| A. | NH4+→NO3- | B. | C→CO | C. | SO2→S | D. | SO2→SO32- |
分析 需要加入还原剂才能实现,则选项中为氧化剂的还原反应,氧化剂中某元素的化合价降低,以此来解答.
解答 解:A.N元素化合价升高,被氧化,应加入氧化剂,故A错误;
B.C元素化合价升高,被氧化,应加入氧化剂才能实现,故B错误;
C.S元素化合价降低,被还原,应加入还原剂,故C正确;
D.元素化合价没有发生变化,不是氧化还原反应,故D错误.
故选C.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化剂、还原剂反应的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应是不可逆反应 |
12.下列离子的检验不能达到预期目的是( )
| A. | 向待测液里加入NaOH溶液,产生红褐色沉淀,则待测液中肯定含有Fe3+ | |
| B. | 向待测液里加入BaCl2溶液,若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42- | |
| C. | 向待测液里加入过量硝酸无现象,再加入硝酸银溶液,若无沉淀生成,则表明待测液中肯定不含Cl- | |
| D. | 向待测液里加入CaCl2溶液,不产生白色沉淀,加入稀盐酸产生无色无味气体,该气体通入澄清石灰水中,溶液变浑浊,则表明待测液中肯定含HCO3- |
9.下列四组溶液混合后,最先出现浑浊的是( )
| 选项 | H2SO4 | Na2S2O3 | H2O |
| A | 5mL0.1mol/L | 5mL0.1mol/L | 0 |
| B | 5mL0.2mol/L | 5mL0.1mol/L | 10 |
| C | 5mL0.3mol/L | 5mL0.1mol/L | 20 |
| D | 5mL0.4mol/L | 5mL0.1mol/L | 30 |
| A. | A | B. | B | C. | C | D. | D |
16.有关反应的离子方程式书写错误的是( )
| A. | Cl2通入NaOH溶液中 Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 硫化亚铁与稀硫酸反应 FeS+2H+═Fe2++H2S↑ | |
| C. | 硫酸铵和氢氧化钡溶液 Ba2++SO42-═BaSO4↓ | |
| D. | 氢氧化钡与稀硫酸反应 Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O |
6.下列关于胶体和溶液的说法中,正确的是( )
| A. | 分散系的分类 | |
| B. | 溶液是电中性的,胶体是带电的 | |
| C. | 光线通过时,溶液产生丁达尔效应,胶体则无丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
10.下列所示的实验装置中,能达到实验目的是( )
| A. |  除去Cl2中的HCl | B. | 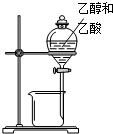 分离乙醇和乙酸 | C. | 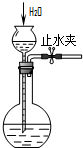 检查装置气密性 | D. |  实验室制取O2 |
4. 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体.
【进行实验】为了验证碳酸氢钠受热时的分解产物,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上充分加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有无色小液滴,证明生成了水.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察有关现象,说明生成了二氧化碳.
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3.
①他们的依据是质量守恒定律(或化学反应前后元素种类不变、化学反应前后原子种类不变、NaHCO3中含有Na、H、C、O元素等,合理答案均可).
②兴趣小组为确定反应后的固体产物成分进行了以下实验,请填写下表:
【讨论与评价】实验一的结论与实验二、实验三的结论相反,兴趣小组的同学认为方案一的结论不正确,他们的理由是碳酸钠溶液呈碱性,也能使溶液变成红色.
【拓展应用】碳酸氢钠常用来治疗胃酸过多,但对于患胃溃疡的病人胃酸(用盐酸表示)过多时,却不宜服用碳酸氢钠,用化学方程式表示其原因是HCl+NaHCO3=NaCl+CO2↑+H2O.
 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体.
【进行实验】为了验证碳酸氢钠受热时的分解产物,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上充分加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有无色小液滴,证明生成了水.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察有关现象,说明生成了二氧化碳.
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3.
①他们的依据是质量守恒定律(或化学反应前后元素种类不变、化学反应前后原子种类不变、NaHCO3中含有Na、H、C、O元素等,合理答案均可).
②兴趣小组为确定反应后的固体产物成分进行了以下实验,请填写下表:
| 实 验 | 实验现象 | 结 论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞溶液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 | 产生白色沉淀 | 固体产物是Na2CO3,而不是NaOH |
| 实验三:取少量反应后的固体产物溶于水,加入足量稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3 |
【拓展应用】碳酸氢钠常用来治疗胃酸过多,但对于患胃溃疡的病人胃酸(用盐酸表示)过多时,却不宜服用碳酸氢钠,用化学方程式表示其原因是HCl+NaHCO3=NaCl+CO2↑+H2O.