题目内容
8.下列各化合物的命名正确的是( )| A. | CH2═CH-CH═CH2 1,3-二丁烯 | B. | CH3COOCH2CH2OOCCH3乙二酸二乙酯 | ||
| C. | CH3CH2CH(OH)CH3 3-丁醇 | D. | 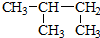 2-甲基丁烷 2-甲基丁烷 |
分析 A.选同时包含两个双键的碳链做主链;
B.该有机物为乙酸与乙二醇通过酯化反应生成的,名称为二乙酸乙二醇;
C.从距离官能团近的一端编号;
D.主链有4个碳原子.
解答 解:A.CH2═CH-CH═CH2中含两个双键的碳链做主链,其名称为:1,3-丁二烯,故A错误;
B.CH3COOCH2CH2OOCCH3的正确名称为二乙酸乙二醇,故B错误;
C.从距离官能团近的一端编号,应为:2-丁醇,故C错误;
D.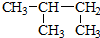 的主链为丁烷,甲基在2号C,符合命名规则,故D正确;
的主链为丁烷,甲基在2号C,符合命名规则,故D正确;
故选D.
点评 本题考查有机物的命名,题目难度不大,明确常见有机物的命名原则为解答关键,注意选取主链碳原子数最多,支链编号之和最小,常见1-甲基、2-乙基都是典型错误.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.关于烃的反应表达式:CnHm(g)+(n+$\frac{m}{4}$ )O2 $\stackrel{点燃}{→}$ nCO2+$\frac{m}{2}$ H2O(g),下列说法不正确的是( )
| A. | 可用于计算烃完全燃烧时的耗氧量 | B. | 式中的m只可能是大于0的偶数 | ||
| C. | 式中的m不可能是小于n | D. | 所表示的反应一定是放热反应 |
3. 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:
请回答下列问题:
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3.
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$ cm3(写出表达式即可).
 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层 上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3.
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$ cm3(写出表达式即可).
20.下列物质中,能与醋酸发生反应的是( )
①石蕊 ②乙醇 ③氢氧化铜 ④金属铝 ⑤氧化镁 ⑥碳酸钙.
①石蕊 ②乙醇 ③氢氧化铜 ④金属铝 ⑤氧化镁 ⑥碳酸钙.
| A. | ①③④⑤⑥⑦ | B. | ②③④⑤ | C. | ①②④⑤⑥ | D. | 全部 |
17.将一盛满Cl2的试管倒立在水槽中,当日光照射相当长一段时间后,试管中最后剩余气体约占试管容积的
( )
( )
| A. | $\frac{2}{3}$ | B. | $\frac{1}{2}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{4}$ |
 短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.
短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应. ,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.
,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-. .
. .
.
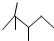 ,有机物 B 与等物质的量的 H2发生加成反应可得到有机物 A.则:
,有机物 B 与等物质的量的 H2发生加成反应可得到有机物 A.则: