��Ŀ����
��֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮���ת����ϵ����ͼ��ʾ�����ֲ�����ȥ����

��1����AΪ���ʣ����A���ʵ�Ԫ������Ȼ�����γɻ�������������Ԫ�ء�
��B���� ���ӣ�����ԡ��Ǽ��ԡ�����B����������ԭ���Ƿ�����8���ӽṹ�� (��ǡ���)��
����50 mL 4 mol/L��NaOH��Һ��ͨ��1.12 L B����״��������Ӧ����Һ�е�����Ϊ_______���ѧʽ�������ʵ����ֱ�Ϊ_____________��
��2����AΪ���������е�Ԫ�����γɵ��Ȼ��
��д��A��Һ��B�����ӷ���ʽ ��
��д��A��B����Һ�з�Ӧ�����ӷ���ʽ ��
��3����AΪ�����Ľ�������E���䡢Ũ��Һ���жۻ�������֪��XΪ���зǼ��Լ������ӻ������1 mol X����38 mol���ӣ���D��Һ�м�����D�����ʵ����Ĺ���X���÷�Ӧ�����ӷ���ʽΪ ��
��1���ٷǼ��ԣ���(2��,��1��)
��NaOH��NaHCO3�� 0.1mol��0.05mol����2�֣���1�֣�
��2��
��Al3++4OH-=AlO2-+2H2O (2��)
��Al3++ 3AlO2-+6H2O=4Al(OH)3 (3��)
��3��4Fe2+ + 4Na2O2 + 6H2O = 4Fe(OH)3 + O2��+ 8Na+ (3��)
����������

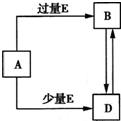 ��֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ�����ȥ��������˵��������ǣ�������
��֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ�����ȥ��������˵��������ǣ������� ��֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ�����ȥ����
��֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ�����ȥ����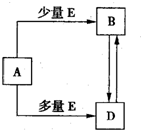 ��֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ�����ȥ����
��֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ�����ȥ����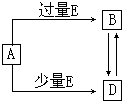 ��֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ�����ȥ����
��֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ�����ȥ����